Комплекс Smc5/6 создает петли ДНК
Белковый комплекс Smc5/6, структурно сходный с когезином и конденсином, формирует петли на ДНК. В новой работе установлено, что он перемещается по ДНК в виде мономеров, но петли образуют только димеры Smc5/6, а также прояснены другие молекулярные аспекты его работы. Полученные данные могут использоваться для изучения противовирусной и противораковой активности Smc5/6.
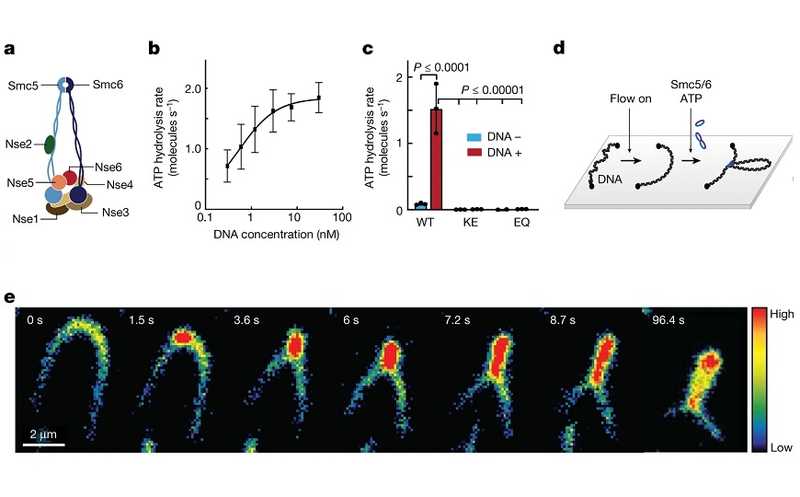
Структура комплекса Smc5/6 и схема эксперимента, в котором изучалось выпетливание ДНК
Credit:
Nature (2023). DOI: 10.1038/s41586-023-05963-3 | CC BY 4.0
Правильная упаковка и пространственная организация ДНК необходимы для полноценного функционирования клеток, включая экспрессию генов, сегрегацию хромосом и репарацию ДНК. В эукариотических организмах за укладку (фолдинг) ДНК отвечают белковые комплексы SMC — конденсины, когезины, а также комплекс Smc5/6. Когезины сворачивает интерфазные хромосомы в хроматиновые петли, формирует топологически связанные домены (TAD); конденсин организует митотические хромосомы в виде иерархически вложенных петель. Известно, что комплекс Smc5/6 участвует в репарации повреждений ДНК посредством гомологичной рекомбинации, обеспечивает сегрегацию хромосом и продвижение репликативной вилки, однако его роль и особенности взаимодействия с ДНК до сих пор не вполне ясны.
Для когезина и конденсина характерен механизм экструзии — в той точке, где комплекс взаимодействует с ДНК, она образует петлю, которая начинает расти и увеличивается до определенного размера. Структурно Smc5/6 сходен с когезином и конденсином: Smc5 и Smc6 вместе с еще шестью белками образуют кольцеобразный октамерный комплекс. Исследователи из Каролинского института (Швеция) и Института биофизики Макса Планка (Германия) предположили, что это структурное сходство обусловливает схожую функциональную активность. Высказывались и другие предположения: например, что ДНК компактизуется за счет взаимодействия с множественными комплексами, или что комплексы Smc5/6 связывают различные участки ДНК. Но, как выяснилось, Smc5/6 действует по тому же принципу, что когезины и конденсины, хотя с некоторыми отличиями.
Авторы статьи, опубликованной в Nature, выделили Smc5/6 из дрожжей Saccharomyces cerevisiae. Сначала они доказали, что комплекс проявляет ДНК-стимулированную АТФазную активность, которая характерна для всех SMC. Ожидаемо, таким свойством не обладали комплексы, в которых белки Smc5 и Smc6 из-за мутации были неспособны связывать и расщеплять АТФ. Затем авторы убедились, что Smc5/6 в присутствии АТФ формирует петли: для этого концы ДНК, флуоресцентно окрашенной, закрепили на стекле в потоке буфера, который придавал молекуле определенную ориентацию, в то же время оставляя ненатянутой. Флуоресцентная микроскопия подтвердила, что происходит выпетливание.
Исследователи оценили скорость экструзии петли по начальным наклонам кривых их роста, а также зависимость образования петель от силы растяжения (всего 6% петель способны образовываться при растяжении ДНК на 60% относительно ее контурной длины). Также было установлено, что Smc5/6, как и конденсин, осуществляет двустороннюю экструзию: длина ДНК равномерно уменьшалась с обеих сторон от точки связывания комплекса. Скорость экструзии и зависимость от силы растяжения оказались примерно такими же, как у когезина и конденсина.
На следующем этапе, используя флюоресцентные метки как для молекулы ДНК, так и для Smc5/6, авторы показали, что белковый комплекс располагается у основания петли и осуществляет активную экструзию нити. Чтобы определить, сколько комплексов нужно для образования петлевого домена, ученые в режиме реального времени отслеживали интенсивность флуоресценции меченых Smc5/6, образующих петлю. Одиночные комплексы перемещались по молекуле ДНК, но не петель не формировали. В то же время пары (димеры) комплекса Smc5/6 были неподвижны, но активно экструдировали петли ДНК. Это отличает Smc5/6 от конденсина, который функционально активен в виде мономеров, и когезина, способного к экструзии как в моно-, так и в димерном состоянии. (Модель экструзии ДНК, опосредованной димером, представлена на рис. 4 в статье.)
Помимо изучения функций полноценного комплекса Smc5/6, ученые определили роль его субъединиц Nse5 и Nse 6. Очищенный от Nse5/6 гексамерный комплекс и пентамер без Nse2 и Nse5/6 также проявляли ДНК-стимулированную АТФазную активность. Однако пентамеры не образовывали петель, следовательно, Nse2 необходим для экструзии. Октамер «дикого типа» и гексамер демонстрировали сходную скорость образования петель и идентичное время пребывания в их составе, но при этом, что удивительно, в присутствии гексамера вероятность появления петель резко выросла. Это значит, что Nse5/6 отрицательно регулирует инициацию петли, но существенно не влияет на динамику экструзии после начала выпетливания. Поскольку одиночные молекулы перемещаются по ДНК, но не образуют петли, авторы предположили, что Nse5/6 ингибирует димеризацию комплекса.Это удалось подтвердить при помощи масс-фотометрии.
С другой стороны, известно, что Nse5/6 нужен для посадки Smc5/6 на хроматин. Чтобы лучше понять картину взаимодействия этого комплекса и ДНК, авторы пропускали через проточную ячейку, в которой находились ДНК и октамерные либо гексамерные комплексы, буфер с высоким содержанием соли. При этом петли сразу исчезали, гексамеры не оставались связанными с ДНК, но некоторое количество октамеров оставалось. Это говорит о том, что комплексы Smc5/6 не связаны с ДНК топологически (то есть не «зацеплены» за нить), а Nse5/6 способствует более устойчивому связыванию.
Предыдущие исследования демонстрируют, что Smc5/6 способен ингибировать развитие определенных вирусов, возможно, защищает от определенных видов рака, а также необходим для нормального развития плода. «Открытие также имеет медицинское значение, поскольку сворачивание ДНК важно для нормальной функции хромосом и предотвращения хромосомных изменений, которые могут привести к заболеванию», — отмечает руководитель работы Камилла Бьёркегрен, профессор кафедры клеточной и молекулярной биологии Каролинского института.
Некодирующая РНК Jpx участвует в формировании петель хроматина
Источники
Pradhan, B., et al. The Smc5/6 complex is a DNA loop-extruding motor. // Nature (2023). DOI:1 0.1038/s41586-023-05963-3
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0







