Макрофаги плаценты позволяют оценить состояние микроглии плода
Микроглия плода и резидентные макрофаги плаценты имеют схожее происхождение и демонстрируют общие транскриптомные сигнатуры, установили исследователи из США. Они предполагают, что макрофаги плаценты могут служить биомаркерами состояния микроглии плода для предсказания риска нарушений нейроразвития, ассоциированных с аномалиями микроглии. В частности, в опытах на мышах микроглия и макрофаги плаценты схожим образом меняли свой транскриптом в ответ на ожирение у матери.
Credit:
Cell Reports, 2024. DOI: 10.1016/j.celrep.2024.114326 | CC BY-NC-ND
Микроглия играет ключевую роль в развитии центральной нервной системы (ЦНС), участвуя в нейрогенезе, фагоцитозе апоптотических клеток и синаптической пластичности. Ранее исследования показали, что неправильное программирование микроглии плода в условиях активации иммунной системы матери — ключевой механизм аномального развития мозга плода, который, вероятно, способствует патогенезу нейродегенеративных и психических расстройств. Однако микроглия плода недоступна для изучения, что делает невозможным раннюю диагностику нейродегенеративных нарушений на основе микроглии.
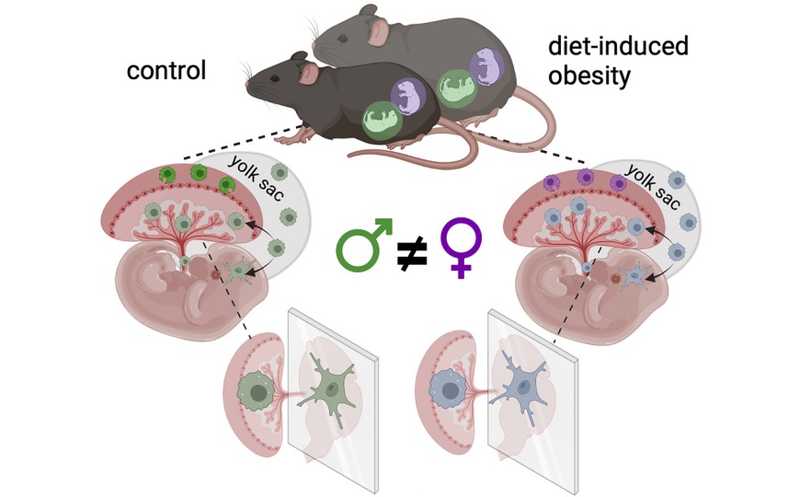
Предшественники многих тканевых резидентных макрофагов, включая микроглию, происходят из желточного мешка плода. В недавно опубликованном исследовании команда под руководством ученых из Массачусетской больницы общего профиля проследила судьбу клеток от желточного мешка до плаценты у мышей и обнаружила, что макрофаги, колонизирующие плаценту, и микроглия плода имеют похожие транскрипционные профили. Авторы предполагают, что плацентарные макрофаги могут отражать неправильные программы развития микроглии и помогать оценить риски возникновения нейродегенеративных расстройств.
Макрофаги, колонизирующие плаценту, называются клетками Хофбауэра (Hofbauer cells). Эти клетки подвержены воздействию той же внутриутробной среды, что и микроглия, а из-за роли в передачи нейротропных вирусов от матери к плоду предполагается, что они связаны с мозгом плода. Также ученые связывают ожирение матери с активацией иммунной системы, что повышает риск развития нейродегенеративных и психических расстройств у плода. Интересно, что пол плода влияет на иммунную реакцию плаценты, и, вероятно, половые различия в воздействии материнского ожирения на развитие микроглии могут объяснять разницу в частоте возникновения этих расстройств между полами. Однако половые различия в программе развития плацентарных макрофагов еще не были описаны.
Чтобы определить, действительно ли плацентарные макрофаги плода происходят из желточного мешка, ученые скрестили две линии трансгенных мышей — Rosa-tdTomatо и Csf1R-CreER. Csf1r активен в прогениторных клетках желточного мешка, таким образом, все клетки, происходящие из желточного мешка, при индукции Cre-рекомбиназы экспрессируют флуоресцентную метку, которую будут нести на более поздних этапах развития. Как и ожидалось, меченные макрофаги были обнаружены как в плаценте, так и в мозге, подтверждая гипотезу о том, что резидентные макрофаги плаценты и микроглия происходят из прогениторных клеток желточного мешка.
Далее ученые провели секвенирование РНК единичных клеток (scRNA-seq), чтобы выявить субпопуляции макрофагов плаценты и мозга у мышиных эмбрионов. Совместная кластеризация макрофагов мозга эмбриона и плаценты показала, что клетки Хофбауэра являются популяцией плацентарных макрофагов, имеющих наиболее схожую транскрипционную сигнатуру с микроглией мозга плода. Авторы работы также проанализировали наборы данных секвенирования РНК плацентарных макрофагов человека. Сравнение профилей экспрессии показало, что клетки Хобфауэра мыши и макрофаги плаценты человека имеют схожие сигнатуры, указывая на высокую степень консервативности резидентных макрофагов между видами.
Затем исследователи изучили, могут ли клетки Хофбауэра отражать изменения микроглии в модели ожирения, индуцированного высокожировой диетой у мышей. Ученые обнаружили, что гены, дифференциально экспрессированные в условиях материнского ожирения, чаще всего были общими между кластерами микроглии эмбриона и клетками Хофбауэра. К тому же, активированные кластеры включали гены, вовлеченные в регуляцию иммунитета и гликолиза. Интересно, что пол плода влиял на то, как материнское ожирение сказывается на его плаценте и мозге. В частности, у самцов было больше нейровоспалительных сигналов, чем у самок; также у них нарушалась экспрессия большего числа генов плацентарных макрофагов и микроглии.
Результаты работы могут лечь в основу диагностики нарушения в развитии микроглии плода с помощью анализа резидентных макрофагов плаценты. Авторы рассчитывают, что схожесть транскрипционных сигнатур макрофагов у мышей и людей позволит экстраполировать данные, полученные на мышах, на эмбрионы человека. «Если мы можем использовать макрофаги плаценты плода в качестве вспомогательного типа клеток или биомаркера программирования микроглии мозга плода, у нас появляется возможность выявить детей, подверженных наибольшему риску из-за внутриутробного иммуноактивирующего воздействия. Выявление таких детей на ранних стадиях создает потенциал для вмешательства в ключевые периоды развития, направленного на смягчение последствий этого воздействия при беременности», — говорит профессор Андреа Эдлоу, старший автор статьи.
Высокожировая диета беременной мыши изменяет поведение потомства в зависимости от пола
Источник
Batorsky et al., Hofbauer cells and fetal brain microglia share transcriptional profiles and responses to maternal diet-induced obesity. // 2024, Cell Reports 43, 114326 June 25, 2024. DOI: 10.1016/j.celrep.2024.114326
Цитаты по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0