Малая молекула для лечения митохондриальных заболеваний
Митохондриальные заболевания, вызванные мутациями в гене POLG, характеризуются тяжелыми симптомами и могут приводить к летальному исходу. Этот ген кодирует митохондриальную ДНК-полимеразу, нарушение ее функции приводит к снижению концентрации мтДНК и препятствует нормальной работе митохондрий. Ученые из Швеции и США представили малую молекулу PZL-A, способную восстанавливать активность несущих мутации полимераз до уровня, сопоставимого с диким типом. Ее действие проверили на культурах клеток пациентов.
Митохондрии в клетке поджелудочной железы (обозначены зеленым)
Credit:
123rf.com
Лидирующая причина митохондриальных заболеваний — мутации в гене POLG, который находится в хромосоме 15 и кодирует ДНК-полимеразу гамма (POLγ). Мутации нарушают функцию полимеразы, что приводит к снижению концентрации мтДНК или делециям в ней и препятствует нормальной работе митохондрий. Заболевания, связанные с мутациями в POLG, могут проявляться как в раннем, так и в позднем возрасте, сопровождаются разнообразными тяжелыми симптомами и способны привести к смертельному исходу, особенно при проявлении до 12 лет. (Именно от этого заболевания умер в марте 2025 года принц Люксембурга Фредерик Нассауский, которому было всего 22 года.) Ученые из Швеции и США представили малую молекулу, способную восстанавливать активность POLγ при широком спектре мутаций.
Учитывая крайнее разнообразие мутаций POLG, авторы вначале проанализировали действие 270 000 соединений на активность POLγ дикого типа, а затем проверяли наиболее эффективные соединения на мутантных формах. Поиск соединений проводился в сотрудничестве с компанией Pretzel Therapeutics.
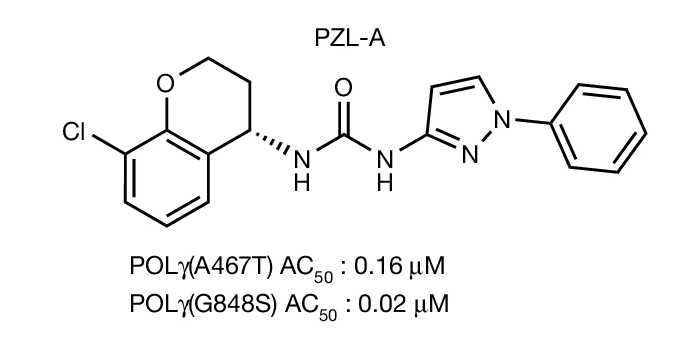
После дополнительных оптимизаций наиболее многообещающей молекулы ученые получили соединение, которое назвали PZL-A. Это вещество повышало активность POLγ, как дикого типа, так с четырьмя мутациями, затрагивающими различные домены, и было активно в небольших количествах — концентрации PZL-A, необходимые для достижения половины максимального эффекта (AC50) составили 20-200 нМ.
Анализ с помощью криоэлектронной микроскопии показал, что PZL-A связывается между субъединицами POLγA и POLγB. Большинство вызывающих заболевания мутаций не влияют на структуру этого региона и не должны препятствовать связыванию PZL-A.
Субъединица POLγB — фактор процессивности полимеразы, то есть ее способности присоединять большое число нуклеотидов за одно связывание с матрицей. Первичные тесты показали, что варианты POLγ, несущие различные мутации (R232H, A467T, W748S и G848S), способны производить лишь короткие фрагменты ДНК, в то время как POLγ дикого типа синтезирует фрагменты длиной до 7,2 т.п.н. Однако добавление PZL-A восстанавливало длину синтезируемых мутантными полимеразами фрагментов почти до уровня дикого типа.
Чтобы подтвердить влияние PZL-A на процессивность полимеразы, исследователи повторили опыт в присутствии гепарина, препятствующего повторному связыванию полимеразы с матрицей. И снова PZL-A восстанавливал длину синтезируемых мутантными полимеразами фрагментов почти до уровня дикого типа. Такой же эффект наблюдался и в тестах с участием полной реплисомы (POLγ, митохондриальной ДНК хеликазы и белка mtSSB).
Наконец, авторы протестировали эффективность PZL-A на клеточных линиях фибробластов, полученных от пациентов, гетерозиготных по мутациям A467T/G848S и W748S/R232H. После подтверждения, что PZL-A не влияет на жизнеспособность клеток, исследователи искусственно снижали концентрацию мтДНК добавлением в культуру бромистого этидия и наблюдали за темпами ее восстановления. Как и ожидалось, в мутантных клетках накопление мтДНК проходило медленнее. Добавление в культуру PZL-A значительно ускоряло накопление мтДНК в мутантных клетках и не влияло на здоровые клетки. Эффект PZL-A был заметен уже при концентрациях порядка 10 нмоль. Примечательно, что такой же эффект наблюдался в линиях, имитирующих постмитотическое состояние клетки, а также в культурах стволовых клеток.
Таким образом, активность мутантных POLγ можно восстановить фармакологическим воздействием, что является многообещающим путем к разработке терапий митохондриальных заболеваний. Авторы планируют продолжать исследование PZL-A на более широком спектре мутаций.
Опухолевые клетки «отравляют» Т-лимфоциты своими дефектными митохондриями
Источник
Valenzuela, S., et al. Small molecules restore mutant mitochondrial DNA polymerase activity // Nature, published April 09, 2025, DOI: 10.1038/s41586-025-08856-9


 Меню
Меню





 Все темы
Все темы
 Nature, 2025, DOI:
Nature, 2025, DOI:




 0
0







