Механизм активации рецептора ССR5 исследовали c помощью криоэлектронной микроскопии
Исследователи из Швейцарии получили структуру рецептора CCR5 в комплексе с его лигандом — хемокином CCL5. Механизм активации CCR5 оказался не таким, как у других хемокиновых рецепторов, которые связывают хемокины с более короткими N-концами, чем у CCL5. Рецептор CCR5 известен своей важной ролью в развитии ВИЧ-инфекции.
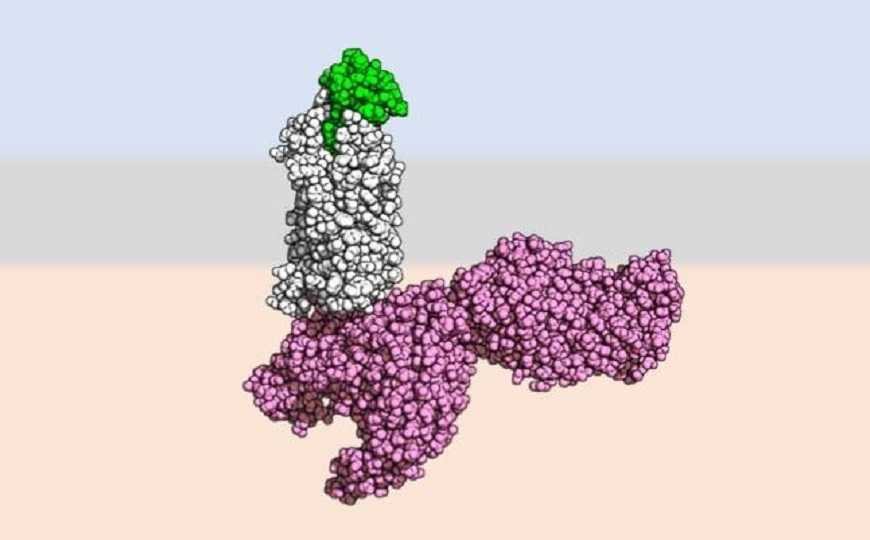
Рецептор CCR5 (серый) в комплексе с цитокином и внутриклеточным эффектором
Credit:
UNIGE- Laboratoire Hartley |
Пресс-релиз
Швейцарские ученые подробно исследовали структуру комплекса C–C хемокинового рецептора 5 (CCR5) с двумя другими белками — его лигандом и эффектором (G-белком). CCR5 активирует иммунные клетки при воспалении, его экспрессия может быть связана с онкогенезом и метастазированием, он также участвует в нейровоспалении и в осложнениях, связанных с COVID-19. Наиболее он известен как корецептор вируса иммунодефицита человека. Чтобы проникнуть в CD4 Т-клетку, ВИЧ присоединяются не только к рецептору CD4 на ее мембране, но и к корецептору, в роли которого может выступать CCR5. Предпринимаются попытки разработать терапию против ВИЧ, нацеленную на этот рецептор. Интересно, что и хемокины — естественные лиганды CCR5, и прежде всего CCL5, препятствует проникновению частиц ВИЧ в клетку, блокируя участок их связывания и индуцируя эндоцитоз рецептора.
Строение ряда хемокиновых рецепторов известно, но конформационные перестройки и структуры комплексов, образующихся при их активации, изучены в значительно меньшей степени. Структура активированного рецептора ССR5, который образует комплекс с хемокином CCL5 и гетеротримером Gi, (этот белок отвечает за передачу сигнала от рецептора в клетку) не была изучена ранее.
Авторы работы, опубликованной в Science Advances, использовали не хемокин «дикого типа», а его оптимизированный для связывания вариант [6P4] CCL5 — сильный агонист CCR5, который ранее исследовался как возможное средство против ВИЧ.
Модель комплекса [6P4] CCL5•CCR5•Gi построена на основании данных, полученных с помощью криоэлектронной микроскопии. Хемокин CCL5 связывается с рецептором посредством длинного N-конца, при этом происходит конформационная перестройка трансмембранных белков рецептора. В отличие от лигандов других хемокиновых рецепторов, таких как ССL20, который связывается с CCR6, СCL5 взаимодействует с более «глубокими» частями рецептора. Авторы сделали вывод, что СС хемокиновые рецепторы могут быть активированы посредством двух механизмов: глубоким и поверхностным взаимодействием с хемокинами.
Что интересно, у многих хемокинов N-конец подвергается посттрансляционным модификациях — еще один возможный уровень регуляции. Так, известно, что отсутствие двух аминокислотных остатков на N-конце CCL5 приводит к ингибированию хемотаксиса иммунных клеток. При конформационных перестройках на N-конце, а также изменении его аминокислотного состава, меняется глубина проникновения в рецептор, что, в свою очередь, влияет на его активацию.
Исследование взаимодействия хемокиновых рецепторов с их лигандами важно с фундаментальной точки зрения: оно вносит вклад в изучение иммунного ответа в целом. Глубокое понимание механизмов активации этого класса рецепторов поможет создать более эффективные лекарства.
Источник
Isaikina et al. // Structural basis of the activation of the CC chemokine receptor 5 by a chemokine agonist // Science Advances, 7, eabg8685 (2021), DOI: 10.1126/sciadv.abg8685


 Меню
Меню





 Все темы
Все темы




 0
0








