Молекулярное типирование детских опухолей высокого риска позволило улучшить клинические показатели у трети пациентов
Ученые и врачи, участвующие в австралийской программе персонализированной медицины ZERO, использовали геномные, транскриптомные и метаболомные данные для диагностики и подбора терапии детского рака. В 5,2% случаев они изменили диагноз, а клиническое улучшение наблюдалось у 30% пациентов, получивших лечение в соответствии с рекомендациями.
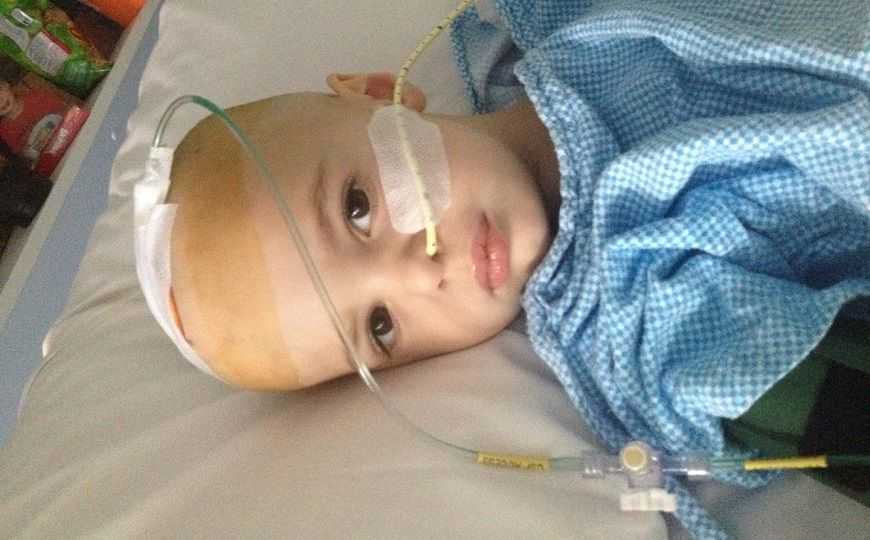
Томасу Эдни было 2,5 года, когда он попал в больницу с опухолями головного и спинного мозга. Множество неточных диагнозов и неудача в терапии привели его в программу ZERO. Исследователи обнаружили мутацию, которая является причиной рака у Томаса. Команда ZERO смогла подобрать терапию, способную воздействовать на мутацию. В ноябре 2019 года Томас смог получить доступ к педиатрическим клиническим испытаниям с использованием препарата Афатиниб. Участие Томаса в испытании было возможно только благодаря программе ZERO, которая профилировала опухоль. В январе 2020 года, после двух месяцев лечения, сканирование мозга Томаса показало заметное улучшение. Сегодня Томасу восемь лет, и он все еще получает терапию. Его опухоль уменьшилась, и он больше не испытывает изнуряющей боли.
Credit:
Children's Cancer Institute
Программа Zero Childhood Cancer Program (ZERO) объединяет многие клиники и исследовательские центры Австралии для исследования и лечения детей со злокачественными опухолями высокого риска и редкими опухолями. В статье в Nature Medicine команда ученых и врачей под руководством Пола Экерта, Марка Коули и Давида Зиглера сообщает о результатах исследования, проводившегося по этой программе с 2015 по 2019 год и включающего данные о 247 пациентах с такими типами рака.
Детский рак относится к одной из основных причин смертей пациентов возрастом до 21 года, вызванных заболеваниями. Рак высокого риска характеризуется менее чем 30% выживаемостью в течение 5 лет после постановки диагноза. Такие опухоли обычно бывают агрессивными либо рецидивирующими, они слабо отвечают на стандартную терапию, а их методы лечения все еще плохо разработаны. Перспективной стратегией лечения таких типов рака является персонализированный подход, направленный на тестирование и выявление молекулярных причин опухоли у каждого конкретного пациента и предоставление специализированных рекомендаций и терапии. В рамках такого подхода в программе ZERO проводят анализ генома, транскриптома и метаболома раковых опухолей.
В исследовании коллектива Экерта, Коули, Зиглера и их коллег полногеномное секвенирование провели для всех идентифицированных 252 опухолей, РНК-секвенирование — для 228, а профили метилирования были получены только для 76 опухолей, относящихся к поражениям центральной нервной системы.
Всего идентифицировали 968 молекулярных аберраций. Всего было идентифицировано 968 молекулярных аберраций. Выяснилось, что 92,1% исследованных опухолей имеют хотя бы один патогенный или вероятно патогенный генетический вариант, затрагивающий онкогенные и опухолевые супрессоры, — однонуклеотидные вариации (SNV), вариации числа копий (CNV) и структуры хромосом, инсерции и делеции, отклонения в экспрессии генов и другие. Так, среди опухолевых SNV чаще всего встречались те, которые затрагивали эпигенетическую регуляцию, клеточный цикл и пути передачи сигналов киназами. Кроме того, при анализе данных полногеномного секвенирования и РНК-секвенирования удалось идентифицировать 67 типов слияний генов, среди которых только 18 были уже известны. Интересно, что у 5,2% пациентов обнаружение специфического варианта привело к смене диагноза.
У 71,4% пациентов обнаруженные аберрации относились к уже известным мишеням для терапии. Чаще всего рекомендовались терапевтические агенты, нацеленные на каскады PI3K/AKT/mTOR, в том числе ингибиторы mTOR.
В исследование было включено 38 пациентов из 43, получивших рекомендованную терапию (только для этой группы данные по терапии были достоверны на момент сдачи рукописи). Для 31% из них было показано клиническое улучшение течения болезни.
Марк Коули, руководитель группы вычислительной биологии в Институте детского рака (Children Cancer Institute) и один из ведущих авторов статьи, отмечает, что использованный подход позволяет ставить пациентам диагнозы, идентифицировать новые возможные варианты лечения и идентифицировать семьи с повышенным риском развития дополнительных онкологических заболеваний у детей.
Источник
Wong, M., Mayoh, C., Lau, L.M.S. et al. // Whole genome, transcriptome and methylome profiling enhances actionable target discovery in high-risk pediatric cancer // Nat Med (2020). DOI: 10.1038/s41591-020-1072-4


 Меню
Меню





 Все темы
Все темы



 0
0