Молекулярный переключатель возрастного хронического воспаления
Ученые исследовали вариант инфламмасомы, который участвует в реакции возрастного хронического воспаления. В опытах на мышах продемонстрирован механизм регуляции за счет ацетилирования основного компонента инфламмасом и подтверждена его обратимость.
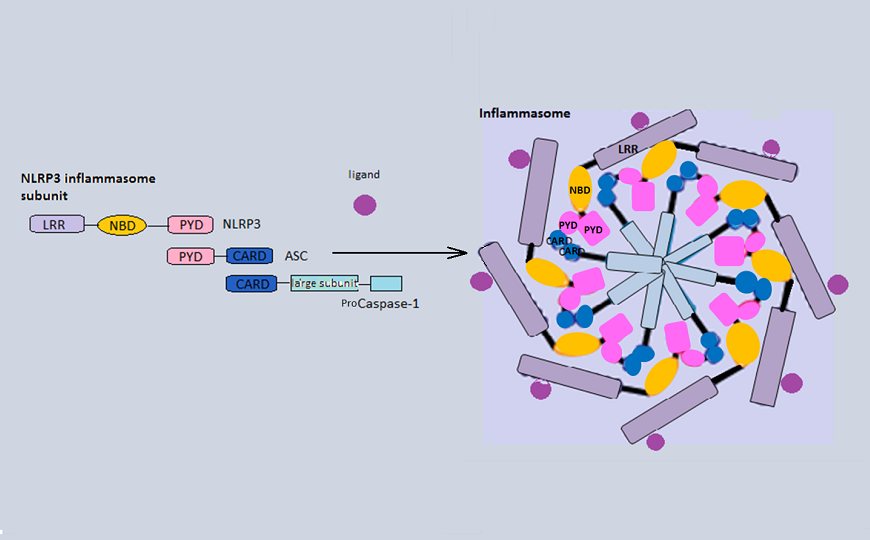
Инфламмасома — белковый комплекс, отвечающий за воспалительный ответ. В состав инфламмасомы входит белок NLRP3, содержащий домены NACHT (NBD), LRR и PYD.
Credit: Aiyaya | Wikipedia | CC BY-SA 3.0Исследователи их США и Китая обнаружили механизм, который регулирует ассоциированное со старением хроническое воспаление. Ключевую роль в нем играет NLRP3 — основной компонент одной из разновидностей инфламмасом. NLRP3-инфламмасома — уникальный сенсор врожденного иммунитета, способный активироваться разными эндогенными метаболическими путями в отсутствие инфекции и вызывать воспалительную реакцию. (Основными цитокинами такого воспаления являются IL-1 и IL-18, зрелые формы которых процессируются при участии NLRP3-инфламмасомы.)
Авторы исследования, опубликованного в Cell Metabolism, продемонстрировали способ регуляции активности NLRP3. Этот белок имеет две формы — активную ацетилированную и неактивную деацетилированную. За регуляцию соотношения двух форм NLRP3 в клетке отвечает цитозольная деацетилаза SIRT2.
Особенности функционирования сигнальной оси SIRT2–NLRP3 сначала протестировали на культуре макрофагов, а затем продемонстрировали влияние этого сигналинга на определенные аспекты старения на мышиной модели.
Сравнение макрофагов, выделенных из организма молодых и старых мышей, показало, что в «старых» макрофагах ниже уровень экспрессии SIRT2 (см. рисунок). Это, в свою очередь, объясняет более высокую активность NLRP3-инфламмасом и более интенсивную продукцию IL-18 в ответ на стимуляцию индуцирующими агентами (нигерицин и АТФ), чем в макрофагах из молодого организма. Авторы показали, что искусственное повышение экспрессии SIRT2 в старых макрофагах снижает инсулинрезистентность — это определяли по профилю экспрессии генов, задействованных в инсулиновом сигналинге.
Следующим этапом стало сравнительное исследование молодых и старых мышей. Молодые мыши, нокаутные по SIRT2, фенотипически были неотличимы от мышей дикого типа, демонстрировали ту же долю жира в организме, уровень IL-18 в крови и реакцию на пробу с сахарной нагрузкой. (Часть метаболических сигналов, активирующих NLRP3-инфламмасому, ассоциированы с ожирением либо старением.) Однако нокаутные по SIRT2 мышей быстрее набирали вес на диете с высоким содержанием жира, при этом у них повысились концентрации глюкозы и инсулина в плазме крови. Кроме того, у таких мышей отмечались нарушения метаболизма глюкозы и снижение чувствительности к инсулину.
Для более полной характеристики роли NLRP3 в возрастном хроническом воспалении мышей облучали, чтобы убить их собственный костный мозг, а затем проводили трансплантацию модифицированных гематопоэтических стволовых клеток. Модификация, приводящая к продукции мутантной формы NLRP3 (такая форма хуже ацетилируется), повлияла на физиологию стареющих мышей; по сравнению с диким типом они имели меньшую концентрацию IL-18 в плазме крови, а также демонстрировали лучшую глюкозотолерантность.
Полученные данные улучшают понимание механизмов, по которым развивается ассоциированное с возрастом хроническое воспаление — это может лечь в основу разработки способов его замедления, поскольку описанный механизм переключения является обратимым. Обратимой при воздействии на сигнальную ось SIRT2–NLRP3 может оказаться и возрастная инсулинрезистентность.
Источник
He, M. et al. // An Acetylation Switch of the NLRP3 Inflammasome Regulates Aging-Associated Chronic Inflammation and Insulin Resistance // Cell Metabolism, 2020; DOI: 10.1016/j.cmet.2020.01.009


 Меню
Меню





 Все темы
Все темы




 0
0