Мутация Крайстчерч даже в неблагоприятном аллеле АРОЕ защищает мышей от болезни Альцгеймера
На риск развития болезни Альцгеймера (БА) влияют различные варианты гена аполипопротеина Е. Вариант АРОЕ3 считается нейтральным, а с заменой APOE3-R136S (вариант Крайстчерч) он обладает протективным действием, предотвращая гибель нейронов и развитие деменции даже в присутствии патогенной мутации в другом гене. Оказывается, защитное действие замены R136S проявляется даже в аллеле APOE4, который способствует развитию «поздней» БА.
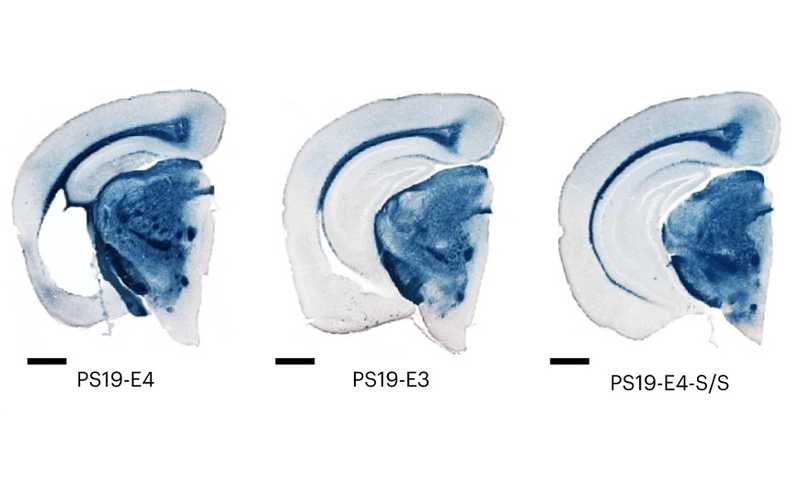
Срезы мозга мышей со склонностью к таупатии, имеющих два аллеля E4, E3, E4 с двумя мутациями Крайстчерч. Окрашивание суданским черным для улучшения визуализации гиппокампа.
Credit:
Nat Neurosci (2023). DOI: 10.1038/s41586-023-06216-z | CC BY 4.0 DEED
Новое исследование в Nature Neuroscience описало механизмы протекторного действия мутации Крайстчерч в гене APOE, предотвращающей болезнь Альцгеймера (БА). У этого распространенного нейродегенеративного заболевания сильно выражена генетическая составляющая. Мутации, повышающие риск заболеть, затрагивают прежде всего гены белка-предшественника бета-амилоида APP, пресенелинов PSEN1 и PSEN2 и аполипопротеина E ApoE.
Ген APOE кодирует белок-участник метаболизма липидов, участвующий и в развитии сердечно-сосудистых болезней. Наиболее известны три его изоформы: ApoE2 снижает риск нейродегенерации, а ApoE4, напротив, его повышает. Вариант Крайстчерч, он же APOEch или APOE-R136S (мутация, приводящая к замене аргинина на серин в положении 136), впервые обнаружен в 1980-е годы у семьи из города Крайстчерч в Новой Зеландии. Этот вариант повышает риск сердечно-сосудистых заболеваний, снижая способность APOE связывать жиры, но по отношению к БА, как выяснилось, обладает протективным действием, даже на фоне других неблагоприятных факторов.
В 2019 году был описан случай жительницы Колумбии, имевшей гомозиготный вариант Крайстчерч APOE3-R136S наряду с высокопатогенным аутосомно-доминантным вариантом пресенелина-1 PSEN1-E280A, из-за которого у многих ее родственников развилась ранняя деменция. Очевидно, протективная мутация нейтрализовала патогенную: женщина умерла от меланомы в возрасте 77 лет, имея лишь умеренные когнитивные нарушения (подробнее на PCR.NEWS). Было показано, что вариант APOEch замедляет образование агрегатов тау-белка как in vivo, так и in vitro, хотя и не снизил уровень бета-амилоида в мозге женщины с патогенным вариантом гена пресенилина. Новая статья в Nature Neurobiology описывает механизмы защитного действия мутации Крайстчерч, то есть замены R136S, в патогенном аллеле APOE4 (а не в нейтральном APOE3, как у женщины из Колумбии).
Аллель APOE4 — наиболее значимый фактор риска болезни Альцгеймера с поздним началом. Авторы использовали разные модели заболевания: трансгенных гуманизированных мышей, имеющих две копии человеческого APOE4, и нейрональные культуры, полученные из ИПСК пациента с болезнью Альцгеймера, также гомозиготного по APOE4. И в геном мышей, и в геном культивированных нейронов вводили мутацию Крайстчерч, приводящую к замене R136S, в ген APOE4 — в один или оба аллеля. Таким образом, и мыши, и нейроны несли протективные мутации в гомо- или гетерозиготном состоянии.
Чтобы изучить влияние замены на тау-патологию, которая сейчас считается ключевой в развитии БА, этих мышей скрещивали с мышами линии Tau-P301S (популярная модель таупатии). Таким образом, в дальнейших исследованиях участвовали четыре группы мышей, все с геном предрасположенности к таупатии, — одна группа были просто гомозиготной по Е4, другая имела мутацию Крайстчерч в одном аллеле, третья — в обоих аллелях, четвертая, контрольная, была гомозиготной по нейтральному аллелю E3 без мутации Крайстчерч.
Методами иммуноцитохимии у мышей в гиппокампе оценивали уровни накопления фосфорилированного тау-белка. Защитная мутация в гомозиготном состоянии снижала проявление патологии примерно до уровня контроля, эффект гетерозиготной мутации был незначительным. Аналогичная картина наблюдалась и в культуре нейронов: гомозиготные мутации снизили уровень фосфорилированного тау на 35–40%, меньше стало и патологических изменений формы клеток.
В поглощении тау-белка нейронами важную роль играют поверхностные гепарансульфаты HSPG, с которыми связывается аполипопротеин Е, причем мутация Крайстчерч ослабляет связывание, а изоформа, кодируемая E4, напротив, связывается лучше. Авторы предположили, что эффект мутации ассоциирован именно с этим механизмом, и подтвердили это в серии экспериментов, где нейроны обрабатывали гепарином, конкурентно подавляющим поглощение тау. Гепарин практически не влиял на клетки с гомозиготной мутацией, в отличие от гетерозигот и гомозигот Е4 и Е3 без мутации. По-видимому, это означает, что HSPG-зависимое поглощение тау-белка в гомозиготных клетках уже снижено.
Еще при обследовании колумбийской пациентки удалось выяснить, что мутация Крайстчерч на фоне злокачественной мутации пресенилина-1 препятствует атрофии гиппокампа и нейровоспалению. У 10-месячных мышей-гибридов, гомозиготных по Е4 и без протективной мутации, объем гиппокампа значительно уменьшился по сравнению с мышами дикого типа и контрольными гибридами, несущими нейтральный аллель Е3. Однако гомозиготная мутация Крайстчерч замедлила атрофию практически до уровня контроля, что авторы назвали «поразительным». Также было подавлено и нейровоспаление.
Результаты РНК-секвенирования единичных ядер различных популяций клеток мозга мыши подтвердили, что мутация Крайстчерч нормализует транскриптомы различных клеточных популяций.
Таким образом, гомозиготная мутация R136S защищает мышей от тау-патологии даже на фоне неблагоприятного аллеля APOE4.
Источник
Nelson, M.R., et al. The APOE-R136S mutation protects against APOE4-driven Tau pathology, neurodegeneration and neuroinflammation // Nature Neuroscience (2023). Published: 13 November. DOI: 10.1038/s41586-023-06216-z


 Меню
Меню





 Все темы
Все темы




 0
0








