Нанобот из ДНК-оригами убивает раковые клетки
Исследователи из Каролинского института в Стокгольме разработали нанобот на основе ДНК-оригами, который уничтожает раковые клетки у мышей. Конструкция остается неактивной, пока не достигнет микроокружения опухоли, где под воздействием низкого рН высвобождает «оружие» — пептиды, запускающие апоптоз. При этом здоровые клетки, вокруг которых рН не снижается, остаются неповрежденными.
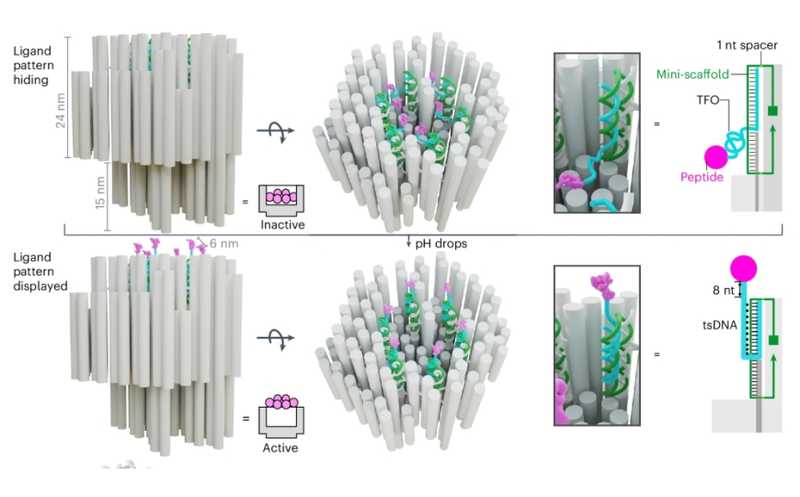
Конструкция из ДНК при низком рН выдвигает наружу упорядоченно расположенные лиганды за счет образования тройных спиралей (справа). Лиганды вызывают кластеризацию рецепторов смерти на опухолевой клетке, и запускается апоптоз.
Credit:
Nature Nanotechnology. 2024. DOI: 10.1038/s41565-024-01676-4 | CC BY 4.0
Нанобот из ДНК, разработанный шведскими учеными, нацелен на рецепторы смерти опухолевых клеток. Суперсемейство рецепторов фактора некроза опухоли (TNFRSF) включает в себя мембранные рецепторы, отвечающие за воспаление, апоптоз, выживание, пролиферацию и дифференцировку клеток. Подсемейство, имеющее домен смерти, включает в себя рецепторами клеточной смерти (DR), которые участвуют в индукции апоптоза. Для запуска апоптоза специфический лиганд должен связаться с рецептором смерти и вызвать его олигомеризацию: каскад апоптоза инициируется после того, как рецепторы на мембране собираются в кластеры.
TNFRSF давно привлекали внимание ученых и врачей как перспективные противоопухолевые мишени, однако разработка эффективной терапии затрудняется тем, что эти рецепторы экспрессируются и на здоровых клетках.
Ранее исследования показали, что определенные члены TNFRSF можно эффективно олигомеризовать путем связывания с лигандами, регулярно расположенными на каркасе, тем самым индуцируя апоптоз. Чтобы точно настроить расстояние между лигандами, несколько научных групп разработало плоские листоподобные ДНК-оригами для крепления лигандов рецептора смерти 5 (DR5) или рецепторов Fas. Гексагонально расположенные лиганды значительно усиливали апоптоз, однако они взаимодействовали и со здоровыми клетками, вызывая нейротоксичность, повышенную восприимчивость к инфекциям и иммунные нарушения.
Известно, что солидные опухоли переключают свой метаболизм на анаэробный гликолиз, вызывая закисление микросреды вокруг опухоли. Исследователи из Каролинского института (Швеция), ранее предложившие одну из плоских конструкций для кластеризации рецепторов, теперь разработали трехмерный ДНК-оригами-переключатель (контейнер вместо открытого листа), который может чувствовать высокую кислотность твердых опухолей. В кислой среде устройство автоматически выводит на поверхность структуры, состоящие из шести полипептидных цепочек, которые собирают в кластеры рецепторы смерти на поверхности клеток, приводя к их гибели.
Искусство создания наноструктур с использованием ДНК в качестве строительного материала называется «ДНК-оригами». Ученые создали структуру размером в десятки нанометров, которая в твердых опухолях, при pH 6,5, открывает лиганд, запускающий апоптоз, в то время как при нормальных физиологических условиях (pH 7,4) лиганды скрываются внутри наноконструкции.
ДНК-оригами выглядит как двойной цилиндр с полой головкой и сплошной ножкой. Внутри головки вертикально расположены «мини-каркасы» — двойные спирали ДНК с выступающими посередине однонитевыми участками, к которым присоединены пептидные лиганды. Однонитевые участки могут образовывать тройную спираль (tsDNA) с верхней частью мини-каркаса, при этом пептиды оказываются снаружи (см. рисунок). Благодаря прикреплению к ДНК-спиралям пептидные лиганды расположены упорядоченно, по углам шестиугольника, что способствует образованию кластера рецепторов.
Исследователи продемонстрировали, что пептидное оружие скрыто внутри наноструктуры при нормальном pH 7,4, но имеет сильный цитотоксический эффект при снижении pH до 6,5. Затем они протестировали наноконструкцию на мышах с опухолями молочной железы. При внутривенном введении ДНК-робот замедлял рост опухоли примерно на 30%. При внутриопухолевом введении ученые наблюдали 70%-ное подавление роста опухоли по сравнению с контрольными группами. Маркеры апоптоза, такие как каспаза-3 и расщепленная каспаза-8, были сильнее представлены в опухолях, обработанных ДНК-роботом.
Эти результаты демонстрируют, что нанобот на основе ДНК-оригами способен индуцировать апоптоз в твердых опухолях, закисляющих среду. До разработки терапии понадобится провести еще множество исследований на других моделях рака и на людях. Тем не менее подход представляется перспективным, в том числе с экономической точки зрения. Благодаря ферментативному и бактериофаговому производству олигонуклеотидов, из которых собирается конструкция (их называют staple — «скрепки»), затраты на производство ДНК-оригами снизились примерно до 200 долларов за грамм, отмечают авторы.
Источник
Wang, Y. et al., A DNA robotic switch with regulated autonomous display of cytotoxic ligand nanopatterns // Nature Nanotechnology (2024). DOI: 10.1038/s41565-024-01676-4


 Меню
Меню





 Все темы
Все темы




 0
0








