ДНК-оригами позволяет управлять сборкой вирусных капсидов
Для контроля сборки структур из капсидных белков вируса можно использовать ДНК-оригами — этому посвящена недавняя работа в Nature Nanotechnology. Таким способом можно получать белковые конструкции разной конфигурации; также капсидная оболочка защищает ДНК от воздействия ферментов. Предложенный подход может найти применение в разработке новых систем доставки препаратов.
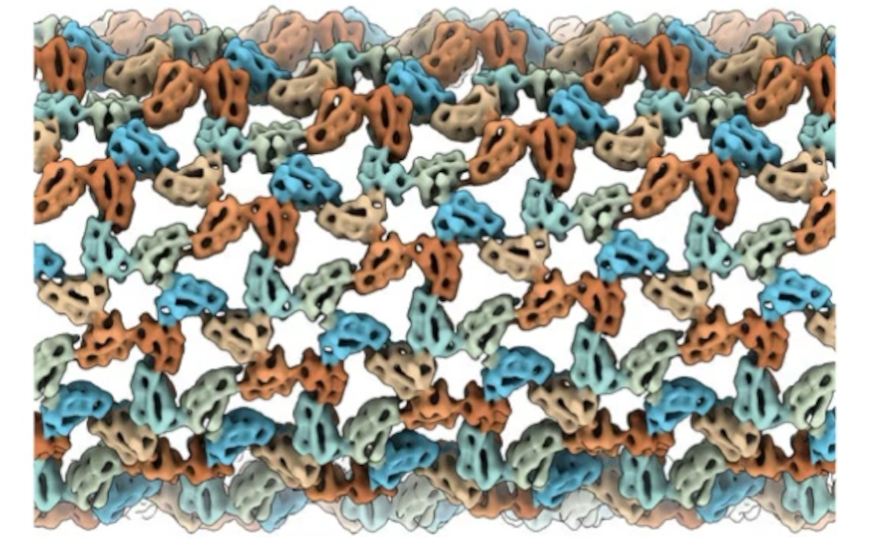
Искусственная сборка белковых структур обладает большим потенциалом для применения в биоинженерии, включая, к примеру, разработку вакцин. Недавно международная группа ученых получила конструкции из белков капсида вируса хлоротичной крапчатости коровьего гороха (CCMV), направляя их сборку при помощи «шаблона» ДНК-оригами.
Капсид CCMV имеет сферическую форму и состоит из 180 копий белка CP, объединенных в гексамеры и пентамеры. Процесс сборки капсида хорошо описан, и ранее ученые уже получали листы, полые сферы и трубки, контролируя условия среды в ходе сборки. Однако более точного контроля за сборкой пока достигнуть не удавалось.
В новой работе исследователи применили ДНК-оригами — технику, позволяющую «складывать» из ДНК структуры различной формы. Полученную таким образом цилиндрическую трубку (обозначенную как 6HB) они помещали в физиологические условия (pH 7.3, 150 мМ NaCl) в присутствии капсидного белка (CP) CCMV. При помощи электрофореза ученые зафиксировали возникновение комплекса между 6HB и CP — выраженность полосы 6HB в геле снижалась, и возникала новая полоса, обладающая значительно меньшей мобильностью. Более того, при достаточной концентрации CP на комплексе образовывался второй слой белка, что было зафиксировано по изменению толщины полученной структуры.
Криоэлектронная микроскопия показала, что CP образует вокруг ДНК-оригами спиральную структуру. При этом спирали первого и второго слоя отличаются по геометрии. Авторы не обнаружили специфических точек контакта между CP и ДНК. Это свидетельствует о том, что сборка комплекса происходит исключительно за счет электронстатических взаимодействий между отрицательно заряженными участками ДНК и положительно заряженными фрагментами CP. При этом в процессе сборки на внешней поверхности структуры также образуется отрицательный заряд, что, вероятно, обеспечивает возможность формирования второго белкового слоя.
Исследователи протестировали возможность «упаковки» в капсид различных структур ДНК: трубок большего диаметра, блокообразных конструкций и колец. Во всех случаях они добились формирования капсида вокруг ДНК. При этом более сложные структуры потребовали большей концентрации CP, а паттерны структуры полученного капсида при этом изменялись. Также авторам удалось заключить в CP ДНК-оригами, несущее золотые наночастицы и даже ДНК-нанокапсулу — структуру, открывающуюся и закрывающуюся в зависимости от pH среды. После заключения в CP и удаления его при помощи гепарина капсула сохраняла свою функциональность.
Было также показано, что капсид защищает ДНК-оригами от действия ДНКазы I, а также стабилизирует его структуру при инкубации с фетальной бычьей сывороткой.
Наконец, авторы получили капсидные комплексы с использованием белков ряда других вирусов, демонстрируя гибкость разработанного подхода.
Таким образом, работа продемонстрировала, что ДНК-оригами можно использовать в качестве «шаблона» для точного контроля за сборкой структур из капсидных белков вирусов. Полученные результаты могут стать основой для разработки новых систем доставки различных соединений.
Новые биосенсоры обнаруживают единичные молекулы с помощью нанопоры и рамок из ДНК
Источник
Seitz, I. et al. DNA-origami-directed virus capsid polymorphism // Nat. Nanotechnol, published July 17, 2023 DOI: 10.1038/s41565-023-01443-x


 Меню
Меню





 Все темы
Все темы




 0
0








