Некомплементарные пары нуклеотидов облегчают регуляторным белкам связывание с ДНК
Ученые из США и Израиля разработали подход для анализа энергетических затрат на изменение конформации ДНК при связывании с транскрипционными факторами. Для этого используются нуклеотидные последовательности с мисмэтчами (ошибочно спаренными нуклеотидами), значительно изменяющими трехмерную структуру молекулы. Обнаружилось, что некоторые белки обладают более сильным сродством к таким последовательностям, чем к тем, которые не содержат ошибок.
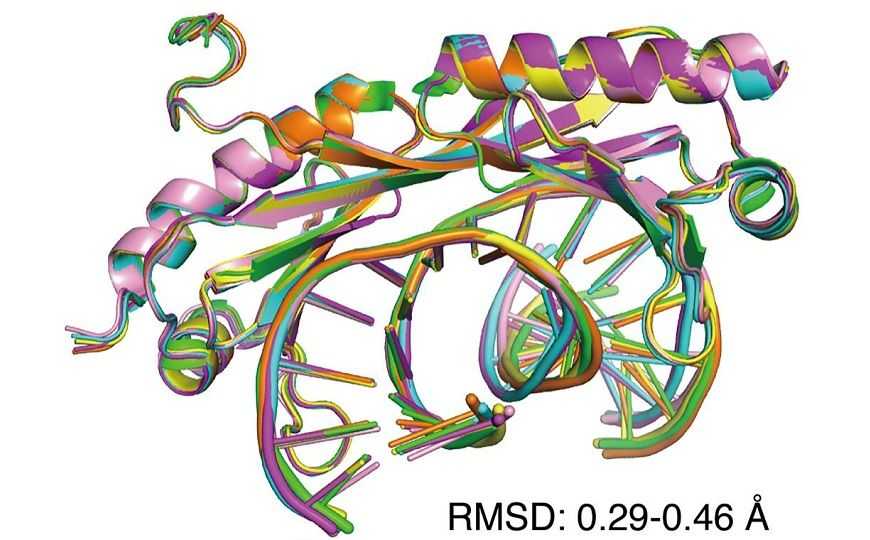
Наложение шести структур ДНК с уотсон-криковскими парами и мисмэтчами, связанных с фактором транскрипции TBP. Белок предпочитает ДНК с мисмэтчами, потому что ее форму легче искажать.
Credit:
Пресс-релиз | Maria Schumacher
Транскрипционные факторы, регулирующие экспрессию генов, связываются с определенными последовательностями в ДНК. Белки узнают свои сайты связывания по нуклеотидному составу и трехмерной структуре. У каждой последовательности есть определенный набор возможных конформаций. Многие транскрипционные факторы изменяют конформацию участка ДНК на менее выгодную, что приводит к энергетическим затратам и снижению сродства белка к последовательности.
Исследования энергетических потерь, сопряженных с нарушением трехмерной структуры, достаточно сложны. Для этого требуется изменять конформацию ДНК, не меняя последовательность нуклеотидов.
Научная группа под руководством исследователей из университета Дьюка (США) предложила изящное решение проблемы: метод, основанный на анализе связывания белков с ошибочно спаренными нуклеотидами (saturation mismatch-binding assay, SaMBA). Неправильно спаренные нуклеотиды («мисмэтч») — типичная разновидность ошибок, возникающих при репликации ДНК, когда в соответствие корректному нуклеотиду в другой цепи ставится некомплементарный. Такой подход позволяет значительно изменять трехмерную структуру молекулы с минимальным изменением последовательности, поскольку такие ошибки затрагивают лишь одну цепь ДНК.
Для проведения SaMBA исследователи использовали микрочипы с одноцепочечными ДНК, представляющими все однонуклеотидные варианты консенсусной последовательности. Затем на микрочип гибридизовали вторую цепочку ДНК, содержащую консенсусную последовательность. Таким образом получался набор ДНК, каждая из которых содержала один из всех возможных вариантов ошибочно спаренных нуклеотидов. После этого ученые добавляли транскрипционный фактор с флуоресцентной меткой. Интенсивность флуоресцентного сигнала они переводили в константу диссоциации, описывающую взаимодействия белка и последовательности ДНК.
Хотя две трети вариантов мисмэтчей ослабляли связывание, для 10% последовательностей сродство к белку увеличивалось (в сравнении с консенсусной последовательностью). При этом для каждого транскрипционного фактора обнаружили хотя бы один вариант ошибочно спаренных нуклеотидов, который улучшал связывание.
Авторы работы решили выяснить, с чем связано повышенное сродство белка к последовательностям с ошибками. Они сравнили структурные изменения, которые вызывают транскрипционные факторы при связывании с молекулой ДНК и те, которые получаются в результате мисмэтча. В 66% процентах случаев они обнаружили сходство между конформациями. Это значит, что ошибочно спаренные основания сами искажают форму ДНК примерно так же, как и транскрипционные факторы. Таким образом, при связывании белка с мисмэтчем отсутствуют энергетические потери, связанные с необходимостью изменения структуры ДНК для получения предпочтительной для белка формы. Кроме того, оказалось, что с некоторыми из ошибочно спаренных нуклеотидов транскрипционные факторы могут образовывать новые, нехарактерные для консенсусной последовательности взаимодействия. Это приводит к дополнительному увеличению сродства белка и участка ДНК.
Исследователи полагают, что такие высокоаффинные взаимодействия могут иметь значения, в частности, для онкогенетики. «Мы уже знаем, что регуляторные участки генома содержат больше раковых мутаций, чем можно было ожидать, — сказала Ралука Гордон, компьютерный биолог из Университета Дьюка. — Мы просто не знаем почему. Сильные взаимодействия между факторами транскрипции и мисмэтчами в ДНК, которые могут препятствовать репарации мисмэтчей, обеспечивают новый механизм накопления мутаций в регуляторной ДНК». Кроме того, даже временный мисмэтч, позднее исправленный, может вызвать связывание фактора транскрипции в неправильном месте и как следствие, неправильную регуляцию гена, переводящую клетку в злокачественное состояние, которое сохраняется даже после исправления несоответствия. Эту возможность трудно проверить, но факты, установленные в этой работе, заставляют о ней задуматься.
Источник
Afek, A., et al. // DNA mismatches reveal conformational penalties in protein–DNA recognition. // Nature, 2020; DOI: 10.1038/s41586-020-2843-2


 Меню
Меню





 Все темы
Все темы




 0
0








