Неврологические симптомы при COVID-19 объясняются реакцией мозга на системное воспаление
Немецкие ученые проанализировали протеом и транскриптом разных участков мозга при острой и поздней стадиях COVID-19. Они не нашли признаков прямого заражения вирусом нейронов, но обнаружили реакцию клеток на системное воспаление. Оно распространяется в мозг через блуждающий нерв, а вызываемые реакцией на воспаление патологические изменения могут объяснять неврологические симптомы при COVID-19.
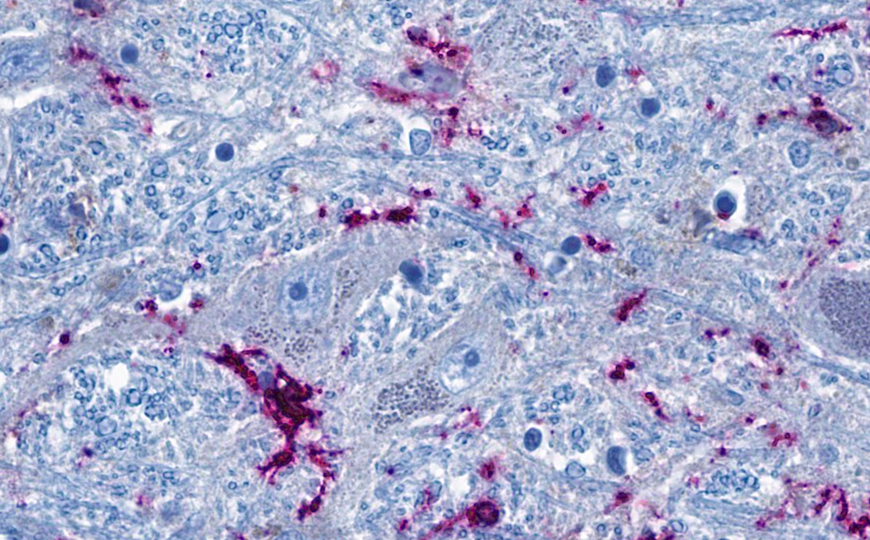
Срез ствола мозга. Нейроны (серо-голубые) находятся в тесном контакте с иммунными клетками (розовые).
Credit:
Charité | Jenny Meinhardt | Пресс-релиз
Наибольшую популярность получили два объяснения того, почему при коронавирусной инфекции возникают неврологические симптомы. Согласно одному из них, SARS-CoV-2 обладает нейротропизмом и вызывает патологические изменения в мозге. Эта позиция подтверждается наличием вирусной РНК и антигенов в тканях мозга некоторых пациентов, хотя до сих пор в нем не находили интактных вирусных частиц. Вторая теория состоит в том, что коронавирусная инфекция вызывает неврологические симптомы косвенно, через системное воспаление. В новой работе немецкие ученые представили молекулярные данные в поддержку этой точки зрения.
Исследователи провели протеомный и транскриптомный анализы посмертных образцов тканей мозга пациентов с коронавирусной инфекцией. Они изучили образцы мозжечка, обонятельных луковиц и ствола мозга. Последние два региона рассматривались как пути, через которые вирус мог проникнуть в центральную нервную систему (ЦНС). Так, обонятельные луковицы расположены близко к слизистой носа — первичного очага инфекции. Ствол мозга, в свою очередь, содержит ядра различных черепно-мозговых нервов, например, блуждающего. Мозжечок рассматривался учеными как контроль, так как этот участок мозга не связан синаптически ни с обонятельной системой, ни с черепно-мозговыми нервами. Также в качестве контроля ученые анализировали легкие и слизистую носа.
Сначала с помощью количественной ПЦР с обратной транскрипцией (ОТ-qПЦР) ученые оценили вирусную нагрузку разных тканей. Наивысшие уровни вирусной РНК обнаружились в легких и слизистых, в тканях мозга ее было мало. Иммуногистохимический анализ также не выявил в тканях мозга нуклеокапсидов коронавируса. Таким образом, ученые не обнаружили признаков прямой инфекции мозга.
Далее авторы проанализировали протеом 82 образцов тканей обонятельных луковиц, мозжечка, ствола мозга и слизистой носа. Всего они выявили около 4 500 различных белков, количество белков варьировало в разных тканях: от 3 000 в слизистых до 4 000 в мозжечке. Исследователи выяснили, что для острой и поздней стадий инфекции характерны определенные протеомные профили. Так, при острой инфекции чаще встречались белки, ассоциированные с сигнальным путем интерферона-гамма. Это было наиболее характерно для ствола мозга и наименее — для мозжечка. Интерферон-гамма участвует в борьбе иммунной системы с вирусными инфекциями и запускает сигнальные каскады, которые приводят к транскрипции различных генов. Экспрессия белков, связанных с интерфероном, была характерна для разных типов клеток: для нейронов, микроглии, макрофагов и эндотелия. В то же время на поздней стадии инфекции белков, связанных с интерфероном, было гораздо меньше. Кроме того, ученые выяснили, что как на острой, так и на поздней стадиях инфекции в стволе мозга значительно понижался уровень белков, связанных с организацией синапсов и с образованием синаптических везикул.
Далее ученые оценили пространственное расположение клеток мозга, реагирующих на системное воспаление, с помощью секвенирования РНК единичных ядер (snRNA-seq) и пространственной транскриптомики. Они выяснили, что иммунореактивные глутаматэргические нейроны преимущественно располагались в ядрах черепно-мозговых нервов, в частности — блуждающего нерва. В то же время реактивные дофаминэргические нейроны встречались во всем стволе мозга. Реактивная микроглия диффузно распространялась по всей белой материи. На уровне транскриптома изменения, затрагивавшие нейроны, также были связаны с нарушениями организации синапсов и образования синаптических везикул.
Анализируя полученные данные, ученые сделали вывод о том, что наибольшую реакцию на интерферон показали макрофаги и эндотелиальные клетки в стволе мозга. Соответственно, они сосредоточили внимание на периваскулярном пространстве. Авторы нашли признаки повышенной проницаемости гематоэнцефалического барьера, которая проводила к попаданию иммунных клеток в мозг. Это было преимущественно характерно для острой стадии болезни. Исследователи охарактеризовали иммунные клетки в периваскулярном пространстве с помощью мультиплексной гистологии и преимущественно выявили CD4+ Т-клетки, а также дважды положительные CD4+ CD8+ Т-клетки — субпопуляцию иммунных клеток, которая также накапливается в легких пациентов при коронавирусной инфекции. Такие клетки вырабатывают провоспалительные цитокины и при этом похожи на CD8+ Т-клетки памяти. Ученые предположили, что эти клетки в периваскулярном пространстве могут способствовать распространению воспаления дальше в мозг и появлению васкулярной микроглии в белой материи.
Таким образом, ученые показали, что коронавирус не поражает мозг напрямую. Инфекция вызывает системное воспаление, которое распространяется в мозг через блуждающий нерв. Это, в свою очередь, влияет на целостность гематоэнцефалического барьера, приводит к проникновению в мозг иммунных клеток и нарушает функции некоторых клеток мозга. Так, ученые предположили, что воспаление может приводить к нарушению профиля нейротрансмиттеров, вырабатываемых нейронами, что, в свою очередь, может объяснять неврологические симптомы при коронавирусной инфекции и после нее.
В то же время исследователи отметили, что многие наблюдаемые при коронавирусной инфекции признаки могут не быть специфическими именно для нее. Так, схожие патологические изменения характерны при сепсисе, системном воспалении, травмах мозга и т. д. Ученые доказали это, использовав в качестве контроля в своем исследовании посмертные образцы тканей от пациентов реанимационного отделения, страдавших от сравнимых с COVID-19 по тяжести полиорганной недостаточности и бактериальных суперинфекций.
Неврологические последствия COVID-19 вызваны нарушением функции тау-белка
Источник:
Radke, J. et al. Proteomic and transcriptomic profiling of brainstem, cerebellum and olfactory tissues in early- and late-phase COVID-19. // Nature Neuroscience (2024). DOI: 10.1038/s41593-024-01573-y


 Меню
Меню





 Все темы
Все темы




 0
0







