Нобелевская премия 2019 по физиологии или медицине присуждена «за открытия того, как клетки адаптируются к изменяющейся доступности кислорода» (for their discoveries of how cells sense and adapt to oxygen availability)
В этом году Нобелевская премия по физиологии или медицине была разделена в равных долях между тремя учеными: Уильямом Г. Келином-младшим (Гарвардская медицинская школа и Институт Говарда Хьюза, США), сэром Питером Дж. Рэтклиффом (Оксфордский университет и Институт Фрэнсиса Крика, Великобритания) и Греггом Л. Семенца (Университет Джонса Хопкинса, США). Они определили молекулярный механизм, который регулирует активность генов в ответ на различные уровни кислорода.
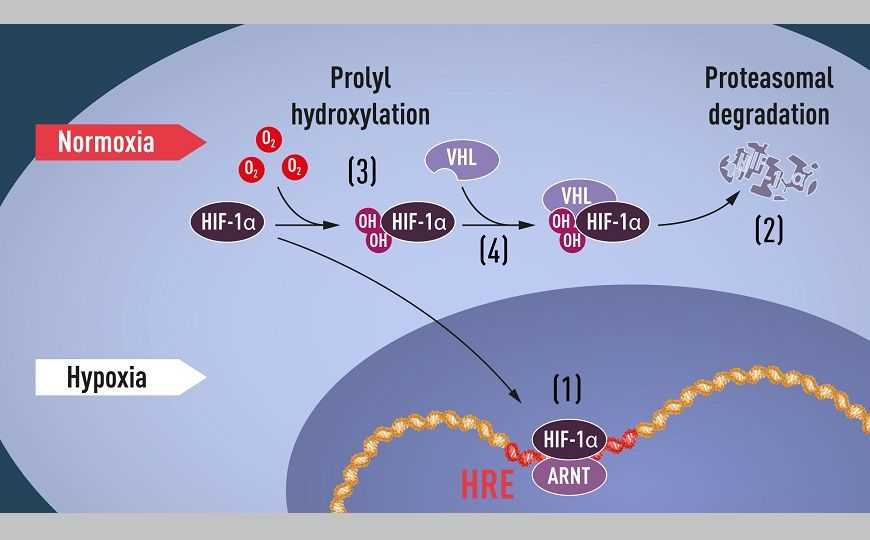
При гипоксии HIF-1α защищен от деградации и накапливается в ядре, где он связывается с ARNT и со специфическими последовательностями ДНК (HRE) в генах, регулируемых гипоксией (1). При нормальном уровне кислорода HIF-1α быстро расщепляется протеасомой (2). Кислород регулирует процесс разложения путем добавления гидроксильных групп (ОН) к HIF-1α (3). Затем белок VHL может распознавать и образовывать комплекс с HIF-1α, что приводит к его кислород-зависимой деградации (4).
Credit: пресс-релиз Нобелевского комитета
Оригинальные открытия, сделанные Нобелевскими лауреатами этого года, раскрыли механизм одного из самых важных адаптационных процессов в жизни. Они заложили основу для нашего понимания того, как уровень кислорода влияет на клеточный метаболизм и физиологические функции. Их открытия также проложили путь к многообещающим новым стратегиям борьбы с анемией, раком и многими другими заболеваниями.
В ходе эволюции были разработаны механизмы, обеспечивающие снабжение кислородом тканей и клеток. Сонная артерия содержит специализированные клетки, которые измеряют уровень кислорода в крови. (Нобелевская премия по физиологии и медицине 1938 года была присуждена Корнелю Хеймансу за открытия, показывающие, как измерение кислорода в крови через каротидные тельца контролирует частоту дыхания.)
HIF выходит на сцену
Существуют и другие физиологические механизмы адаптации к низким уровням кислорода, то есть гипоксии. Ключевым физиологическим ответом на гипоксию является повышение уровня гормона эритропоэтина (ЭПО), что приводит к увеличению продукции эритроцитов (эритропоэз). Важность гормонального контроля эритропоэза была известна еще в начале XX века, но как этот процесс контролировался O2, оставалось загадкой.
Грегг Семенца использовал генно-модифицированных мышей, чтобы изучить работу гена эритропоэтина и то, как этот ген регулируется изменением уровня кислорода. Сэр Питер Рэтклифф также изучал O2-зависимую регуляцию гена эритропоэтина, и обе исследовательские группы обнаружили, что механизм восприятия кислорода присутствует практически во всех тканях, а не только в клетках почек, где обычно вырабатывается эритропоэтин. Это были важные результаты, показывающие, что механизм был общим во многих различных типах клеток.
Семенца хотел идентифицировать клеточные компоненты, опосредующие этот ответ. В культивируемых клетках печени он обнаружил белковый комплекс, который связывается с идентифицированным сегментом ДНК кислородно-зависимым образом. Он назвал этот комплекс фактором, индуцируемым гипоксией (Hypoxia-inducible factor, HIF). После очистки комплекса HIF Семенца в 1995 году опубликовал некоторые из своих основных результатов, включая идентификацию генов, кодирующих HIF. Было обнаружено, что HIF состоит из двух различных ДНК-связывающих белков, факторов транскрипции, которые теперь называются HIF-1α и ARNT. Теперь исследователи могли начать решать головоломку, чтобы понять, какие дополнительные компоненты задействованы и как работает механизм ответа на гипоксию в целом.
VHL: неожиданный партнер
Когда уровень кислорода высокий, клетки содержат очень мало HIF-1α. Однако, когда уровень кислорода низок, количество HIF-1α увеличивается, так что он может связываться с геном эритпропоэтина и, следовательно, регулировать его вместе с другими генами, имеющими HIF-связывающие сегменты ДНК. Несколько исследовательских групп показали, что HIF-1α, который обычно быстро разлагается, защищен от разложения при гипоксии. При нормальном уровне кислорода клеточный аппарат, называемый протеасомой, разлагает HIF-1α. В таких условиях к пептиду HIF-1α добавляется небольшой пептид убиквитин. Убиквитин функционирует как метка для белков, предназначенных для деградации в протеасоме. Как убиквитин связывается с HIF-1α зависимым от кислорода образом, осталось на тот момент центральным вопросом.
Ответ пришел с неожиданного направления. Примерно в то же время, когда Семенца и Рэтклифф изучали регуляцию гена эритропоэтина, исследователь рака Уильям Келин-младший исследовал наследственный синдром, болезнь Гиппеля-Линдау (англ. — VHL). Это генетическое заболевание приводит к значительному увеличению риска некоторых видов рака в семьях с наследственными мутациями гена VHL. Келин показал, что VHL кодирует белок, который предотвращает возникновение рака. Келин также показал, что раковые клетки, лишенные функционального гена VHL, экспрессируют аномально высокие уровни генов, регулируемых гипоксией; а когда ген VHL был повторно введен в раковые клетки, нормальные уровни экспрессии восстанавливались.
Кислород и патологии
Кислородный механизм регуляции экспрессии генов занимает центральное место в большом количестве заболеваний. Например, пациенты с хронической почечной недостаточностью часто страдают от тяжелой анемии из-за снижения экспрессии эритропоэтина. В опухолях этот механизм используется для стимуляции образования кровеносных сосудов и изменения метаболизма, в результате чего раковые клетки усиленно пролиферируют.
Усилия, предпринимаемые в академических лабораториях и фармацевтических компаниях, теперь направлены на разработку лекарств, которые могут воздействовать на различные заболевания, активируя или блокируя чувствительный к кислороду механизм.


 Меню
Меню





 Все темы
Все темы




 0
0








