Новые наночастицы доставляют препарат для химиотерапии и активируют иммунитет
Ученые из США представили новые наночастицы для одновременной доставки в опухоль химиотерапевтических препаратов и малых интерферирующих РНК, ингибирующих экспрессию скрамблазы Xkr8. Данный подход позволяет не только таргетно доставить химиотерапевтический препарат в опухоль, но и предотвратить презентацию раковыми клетками фосфатидилсерина — маркера нормального апоптоза, подавляющего иммунный ответ. Эффективность наночастиц показали на мышиной модели.
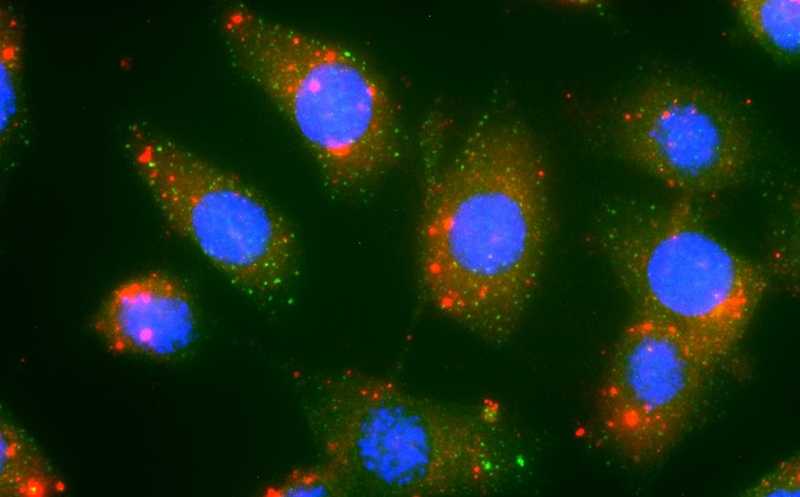
Наночастицы FuOXP-siRNA (красные) поглощаются раковыми клетками. Синим обозначены клеточные ядра.
Credit:
Chen et al., 2022, Nature Nanotechnology, 10.1038/s41565-022-01266-2
Подавление иммунитета — один из основных инструментов выживания рака. Чтобы предотвратить активацию иммунитета, раковые клетки презентуют на своей поверхности молекулярные маркеры нормального апоптоза. Группа ученых из США разработала наночастицы, позволяющие осуществлять одновременную доставку агентов химиотерапии и малых интерферирующих РНК, блокирующих презентацию фосфатидилсерина — одного из маркеров нормального апоптоза.
Фосфатидилсерин (PS) — компонент клеточной мембраны, который в норме содержится исключительно во внутреннем слое. Такое ассиметричное распределение поддерживается за счет активности мембранных ферментов — флипаз. В процессе апоптоза активность флипаз ингибируется и повышается активность белков скрамблаз, которые нарушают ассиметричное состояние мембраны, случайным образом распределяя фосфолипиды по слоям. Находящийся на внешней мембране PS узнается рецепторами на поверхности макрофагов и провоцирует поглощение ими апоптотической клетки. PS также функционирует как контрольная точка иммунного ответа, подавляя активность иммунных клеток и обеспечивая «тихую» уборку апоптотических клеток в нормальном состоянии организма.
Ранее опубликованные исследования показали повышение экспрессии Xkr8 — одной из основных скрамблаз — в тканях рака в ответ на химиотерапию как in vitro, так и in vivo. Предполагается, что данный механизм является защитной реакцией рака, подавляющей иммунный ответ. В новом исследовании ученые подтвердили факт повышения экспрессии Xkr8 в ответ на обработку культуры клеток колоректального рака линии CT26 агентом химиотерапии FuOXP (конъюгатом 5-фторурацила и оксоплатина).
Ученые разработали наночастицы для совместной доставки FuOXP и малых интерферирующих РНК, подавляющих экспрессию Xkr8 (siXkr8). Наночастицы состоят из образованных специальным полимером PMBOP мицелл, несущих внутри FuOXP. siXkr8 образуют комплекс с мицеллами, оборачиваясь вокруг них, что дополнительно повышает стабильность наночастиц.
Полученные наночастицы имеют положительный заряд, что крайне негативно сказывается на способности системы доставлять вещества к опухоли in vivo. Для решения этой проблемы наночастицы покрывали слоем отрицательно заряженного хондроитинсульфата (CS) или комплекса CS с полиэтиленгликолем (PEG-CS). Частицы покрывали комплексом PEG-CS в попытке снизить ожидаемый захват наночастиц CD44+ клетками печени, так как CS является лигандом CD44. Способность системы к высвобождению активных веществ проверили в мышиной сыворотке крови. Ученые также продемонстрировали способность наночастиц защищать siXkr8 от РНКаз. Новые наночастицы получили название PMBOP-CP.
Далее авторы изучили динамику распространения и накопления меченных siXkr8 (Cy5.5-siRN) в различных тканях in vivo. Для этого они использовали мышиную модель, несущую опухоли из клеток линии CT26). Анализ при помощи платформы IVIS, позволяющей получать изображения неинвазивным способом, показал, что свободная РНК распадалась практически сразу после введения, а положительно заряженные PMBOP-CP накапливались преимущественно в легких. PMBOP-CP с покрытием более таргетно накапливались в тканях рака, при этом покрытые CS наночастицы накапливались активнее, чем покрытые PEG-CS. Схожие результаты были получены и на ряде других раковых линий. При этом ученые отдельно отмечают успешную доставку наночастиц в метастатические раки, с чем часто возникают проблемы у систем доставки на основе наночастиц.
Различия в накоплении между CS и PEG-CS позволили ученым предположить, что таргетный захват CS играет важную роль в успехе доставки наночастиц. Дальнейшие опыты показали, что накопление PMBOP-CP в тканях рака было значительно снижено у CD44−/− мышей. Накопление наночастиц в тканях также значительно снижалось в мышиной модели-«зомби». Полученный результаты указывают на ключевую роль активного захвата наночастиц при доставке.
Наконец, ученые продемонстрировали эффективность siXkr8 в предотвращении мембранной презентации PS раковыми клетками при терапии FuOXP как на клеточных культурах, так и in vivo. Терапия наночастицами PMBOP-CP вела к значительному уменьшению размера опухоли у мышиной модели, а также к активации иммунного ответа. при этом не происходило индукции системного воспаления — уровни воспалительных цитокинов в плазме крови не изменялись. Терапия PMBOP-CP не приводила к патологическим изменением основных органов.
Таким образом, ученые представили новую систему комбинированной доставки препаратов химиотерапии и малых интерферирующих РНК. Они считают, что подобная комбинированная иммунохимиотерапия может значительно повысить эффективность лечения ряда раковых заболеваний.
Источник:
Chen Y., et al. Targeting Xkr8 via nanoparticle-mediated in situ co-delivery of siRNA and chemotherapy drugs for cancer immunochemotherapy // Nature Nanotechnology (2022). DOI: 10.1038/s41565-022-01266-2


 Меню
Меню





 Все темы
Все темы




 0
0








