Новые органеллы для производства белков с неканоническими аминокислотами
Альтернативная трансляция с использованием неканонических аминокислот — один из методов синтетической биологии. Новые двумерные немембранные органеллы, закрепленные на клеточных мембранах, могут работать как независимые сайты альтернативной трансляции. Каждый такой сайт специализируется на определенной трансляционной программе. Альтернативная трансляция происходит во всех сайтах одновременно, при этом каноническая трансляция в клетке не нарушается.
Ученые из Германии разработали способ локализации в одной клетке множества точек альтернативной трансляции — специально собранных для этого немембранных органелл.
Альтернативная, или ортогональная, трансляция представляет интерес для синтетической биологии — с ее помощью можно получить in vivo белки со специфическими функциями. Расширение генетического кода (GCE) — мощный инструмент синтетической биологии. Он позволяет включать в определенные участки транслируемого белка неканонические аминокислотные остатки (ncAA) за счет работы аминоацил-тРНК-синтетаз (aaRS) в парах с тРНК из организмов, эволюционно удаленных от тех, в которых происходит процесс трансляции. Для GCE в клетках млекопитающих часто используют пару ncAA/aaRS из археи, связанную с относительно редким стоп-кодоном TAG (амбер-кодон), который при ортогональной трансляции кодирует аминокислоту пирролизин. Одно из ограничений метода GSE связано с неспецифичностью трансляции, приводящей к ошибкам в трансляции нецелевых мРНК транскриптома клетки.
Ранее команда из Института молекулярной биологии (Майнц, Германия) и Университета Майнца имени Иоганна Гутенберга предложила решение этой проблемы: альтернативную трансляцию можно локализовать в отдельном клеточном компартменте. В работе, опубликованной два года назад в Science, они описали специальную немембранную органеллу-конденсат для альтернативной трансляции. Органелла сформирована белками, слитыми с пирролизил-тРНК-синтетазой (PylRS) и капсидным белком бактериофага ms2 (MSP). PylRS эффективно затаскивает пирролизиновую тРНК внутрь органеллы. На 3'UTR целевой мРНК навешивается специальная структура, которая связывается с MSP и за счет этого также захватывается в органеллу. Таким образом, внутри конденсата мРНК транслируется по пути GSE, тогда как во всей окружающей клетке идет каноническая трансляция.В новой работе эти же авторы показали, что можно использовать множественную систему двумерных белковых конденсатов для образования пленочных микросред, на которых эффективно запускается альтернативная трансляция.
Ученые использовали амбер-кодон для трех трансляционных программ с тремя разными ncAA. Сборка органелл происходила в соответствии с тремя правилами: органеллы должны формироваться независимо друг от друга; каждая органелла должна рекрутировать специфический набор мРНК; aaRS в каждой органелле должна специализироваться по своей ncAA. Сами органеллы прикрепляли к мембранам других клеточных структур: плазматической мембране, ЭПР, мембране аппарата Гольджи и митохондриальной мембране. Для этого белки, формирующие конденсат, сливали с белком FUS, разделяющим фазы, а FUS — с трансмембранными доменами белков, локализующихся в разных мембранах. Для визуализации процесса в клетках и оценки интенсивности трансляции в органеллах использовали двуцветный флуоресцентный репортер. С помощью флуоресцентной гибридизации in situ и микроскопии с высоким разрешением подтвердили, что в синтетических органеллах концентрируется большое количество пирролизиновых тРНК и рибосом.
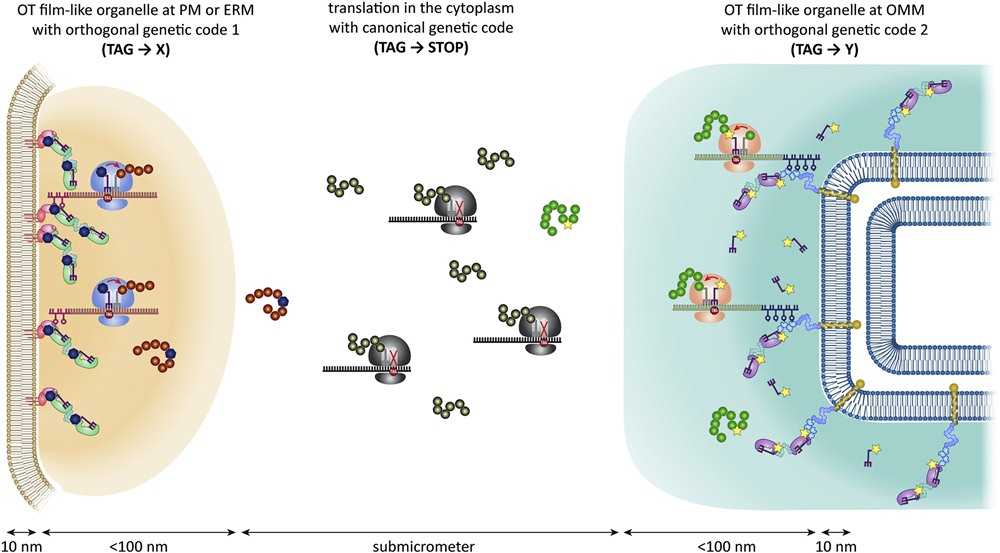 На рисунке изображены органеллы для ортогональной трансляции. Клетка схематически поделена на три зоны, в которых происходят альтернативная или каноническая трансляция. Звездочка и многоугольник — неканонические аминокислоты, коричневые и зеленые шарики — канонические аминокислоты, трезубец с ручкой — эндогенная тРНК. Christopher Reinkemeier and Edward A. Lemke, 2021, DOI:
10.1016/j.cell.2021.08.001
На рисунке изображены органеллы для ортогональной трансляции. Клетка схематически поделена на три зоны, в которых происходят альтернативная или каноническая трансляция. Звездочка и многоугольник — неканонические аминокислоты, коричневые и зеленые шарики — канонические аминокислоты, трезубец с ручкой — эндогенная тРНК. Christopher Reinkemeier and Edward A. Lemke, 2021, DOI:
10.1016/j.cell.2021.08.001
«Самое большое достижение в том, что мы смогли создать чрезвычайно маленькие реакционные пространства, и мы можем разместить несколько таких пространств в клетке одновременно, — говорит руководитель работы Эдвард Лемке, профессор биофизики Университета Майнца имени Иоганна Гутенберга. — Мы превратили большие трехмерные органеллы в двумерные органеллы на поверхности мембраны и даже можем проводить сложные биохимические реакции в этих тонких слоях».
Источник
Christopher Reinkemeier and Edward A. Lemke. Dual film-like organelles enable spatial separation of orthogonal eukaryotic translation. // Cell, August 24 (2021) DOI: 10.1016/j.cell.2021.08.001


 Меню
Меню





 Все темы
Все темы




 0
0








