Новый метод генетического анализа CRISPRi-seq ищет уязвимые места пневмококка
Предложен новый метод для выявления генетических факторов вирулентности пневмококка, влияющих на развитие бактериальной пневмонии. В экспериментах на мышах удалось наблюдать сокращение бактериальной популяции под ударом иммунного ответа, а также идентифицировать гены, важные для развития бактериальной пневмонии, в том числе на фоне гриппа.
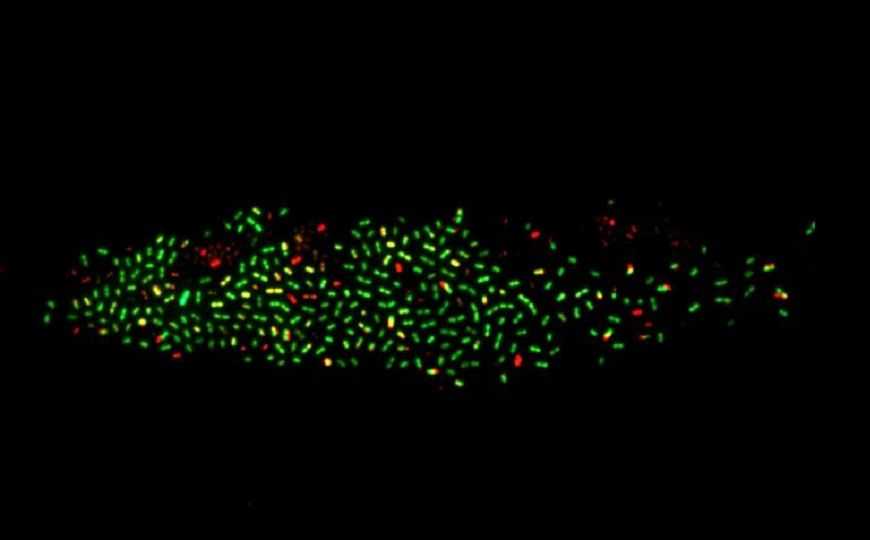
Проверяя метод, авторы использовали CRISPRi для контроля экспрессии различных флуоресцентных белков.
Credit:
Пресс-релиз | J. Kimmey
Пневмококк (Streptococcus pneumoniae) — условно-патогенный микроорганизм носоглотки человека, однако он способен вызывать тяжелые заболевания, когда проникает в обычно стерильные участки организма. Пневмококк может быть причиной сепсиса, менингита, пневмонии с высоким риском для здоровья, особенно при сопутствующей инфекции вируса гриппа A. Хотя часть ключевых факторов вирулентности хорошо изучена, все еще неизвестно, играют ли какую-то роль в прогрессировании заболевания другие гены пневмококка.
Авторы статьи в Cell Host & Microbe предложили новый метод функционального анализа генов, чтобы выявить те, которые влияют на вирулентность Streptococcus pneumoniae. Они использовали CRISPR-интерференцию (CRISPRi), разработанную в лаборатории Дженнифер Дудны в 2013 году. CRISPRi подавляет экспрессию определенных генов, почти не влияя на другие. Гидовая РНК (sgRNA) направляет на целевой участок «мертвую» Cas-нуклеазу (dCas), которая взаимодействует с ДНК, но не разрезает ее, а только препятствует транскрипции конкретного гена.
Гены двух основных элементов системы CRISPRi — dcas9 и sgRNA — были интегрированы в хромосому пневмококка, dcas9 управлялся промотором, индуцируемым тетрациклиновыми антибиотиками, а sgRNA — постоянно активным промотором. Экспрессию dCas9 индуцировали доксициклином, поскольку этот способ изучен на моделях грызунов и широко применяется из-за хорошего проникновения этого антибиотика в ткани. Доксициклин не подавлял рост пневмококков, потому что они обладали устойчивостью к нему.
Авторы создали библиотеку CRISPRi в клетках пневмококка, включающую 1499 гидовых РНК и нацеленную на 2111 из 2146 генетических элементов прототипного штамма S. pneumoniae D39V. Эту технологию они комбинировали с секвенированием Illumina, чтобы количественно определить, какая именно гидовая РНК экспрессируется в клетках пневмококка, колонизирующих организм, следовательно, подавление каких генов менее критично для инфекции. Таким образом, метод, названный авторами CRISPRi-seq, позволяет определить вклад каждого оперона бактерии в ее относительную приспособленность.
Преимущество CRISPRi-seq перед традиционными методами скрининга с применением транспозонов заключается в том, что можно протестировать все гены; с помощью транспозонных библиотек трудно полностью покрыть геном.
Исследователи определили гены пневмококка, важные для вирулентности in vitro и in vivo. Мышей заразили интратрахеально библиотекой CRISPRi, то есть пневмококками, содержащими системы CRISPRi, нацеленные на все опероны, причем в каждой клетке выключался только один из всех. Бактерии выделяли через 24 ч (из легких) и через 48 ч (из легких, из крови). При этом сравнивали мышей, у которых активировали CRISPRi с помощью доксициклина, с теми, кто также был инфицирован библиотекой, но доксициклина не получал. Данные по мышам сопоставили с данными in vitro, для пневмококка, растущего на питательной среде.
На раннем этапе инфекции случайная часть бактериальной популяции погибает из-за стресса, вызванного иммунным ответом. CRISPRi-seq позволяет оценить значимость такого «бутылочного горлышка». «Легкие действительно хорошо справляются с инфекцией, — говорит соавтор статьи Жаклин Кимми из Калифорнийского университете в Санта-Крус. — Даже когда мы давали мышам достаточно большое количество бактерий, “бутылочное горлышко” было узким, и очень мало бактерий попало в кровь». Тем не менее всего 25 выживших бактериальных клеток могут вызвать болезнь.
Хотя мыши были генетически идентичны и инфицировались по тщательно контролируемому протоколу, не было закономерности в том, какие штаммы проходят через «горлышко», а его «ширина» сильно варьировала. Кимми отмечает, что очень интересно наблюдать эту вариабельность в контролируемых условиях, ведь и клиническое течение бактериальной пневмонии у людей сильно различается. Было бы важно узнать, какие варианты иммунного ответа лучше всего сокращают популяцию бактерий.
Также не было особого различия между экспериментальной и контрольной группой мышей: стресс от иммунного ответа затмил действие CRISPRi на бактерий. Однако разница между вкладами генов в приспособленность in vivo и in vitro помогла уточнить список терапевтических мишеней. Авторы выявили семь мишеней гидовых РНК, нейтральных при выращивании пневмококка in vitro, но с существенным эффектом in vivo. Среди них удалось подтвердить значимость гена purA, фермента аденилосукцинатсинтетазы, нужного для биосинтеза пуринов, и оперон cps, необходимый для производства бактериальной капсулы.
Другие гены были необходимыми in vitro, но оказались второстепенными in vivo. MetK, фермент SAM-синтетаза, ранее был идентифицирован как потенциальная лекарственная мишень для лечения туберкулеза, но у пневмококка ген этого фермента оказался неважным in vivo, а значит, непригодным для лекарственного воздействия.
Ученые также добавили грипп в систему, заразив мышей вирусом гриппа А до введения S. pneumoniae. У этих мышей небольшая доза бактерий вызывала безудержную инфекцию в легких, без всякого «бутылочного горлышка», и удалось идентифицировать гены, важные для этого процесса; purA вошел в их число.
Удивительно, но ген основного токсина бактерий, пневмолизина, не был необходимым. Вероятно, пневмолизин более важен для передачи инфекции, чем для выживания в организме хозяина.
Таким образом, CRISPRi-seq может быть использована для изучения патогенеза бактериальной пневмонии, иммунного ответа на нее, терапевтических вмешательств и т.д.
Источники
Jacqueline M. Kimmey, et al. // Exploration of bacterial bottlenecks and Streptococcus pneumonia pathogenesis by CRISPRi-seq // Cell Host & Microbe, 2020, DOI: 10.1016/j.chom.2020.10.001
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0