Новый редактор РНК исправил мутацию в зеленом флуоресцирующем белке
Японские ученые создали систему для редактирования РНК на основе дезаминазного домена APOBEC1 и гидовой РНК, комплементарной РНК-мишени. Новую систему они опробовали на мРНК синего флуоресцентного белка, заменив в ней одно азотистое основание и превратив его в зеленый флуоресцентный белок.
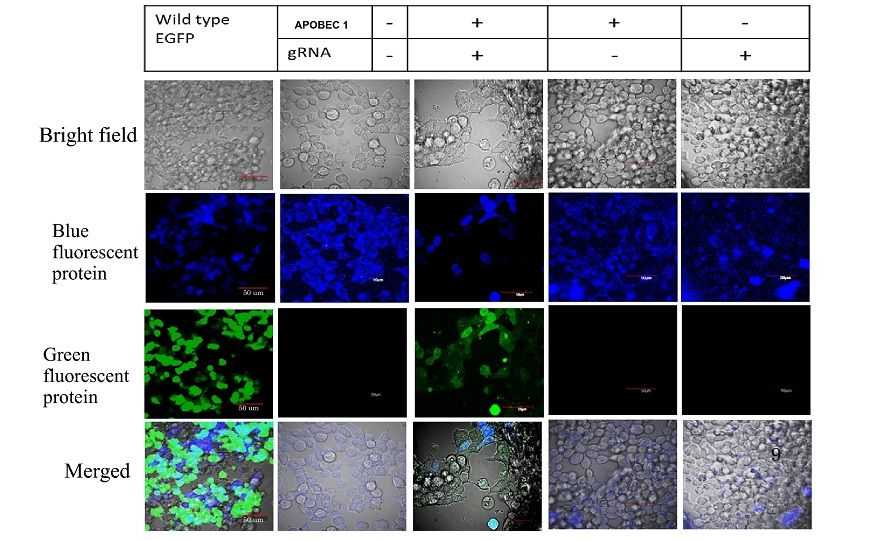
Клетки HEK 293 трансфицировали GFP дикого типа, одним фактором (APOBEC1 или направляющая РНК) или двумя факторами (APOBEC1 и направляющая РНК). Зеленая флуоресценция наблюдалась только при наличии двух факторов, таким образом, они оба были необходимы для замены C-to-U.
Credit:
Scientific Reports, 2020; DOI: 10.1038/s41598-020-74374-5 | CC BY 4.0
Японские исследователи на страницах Scientific Reports сообщили о создании нового редактора РНК, превращающего цитозин в урацил. Основу новой редактирующей системы составил дезаминазный домен белка APOBEC1 и гидовая РНК, комплементарная РНК-мишени. Авторы заявляют, что полученная ими система имеет большие перспективы как метод лечения генетических болезней, обусловленных точечными заменами тимина на цитозин.
Ферменты группы APOBEC осуществляют редактирование мРНК аполипопротеина B, заменяя цитозин на урацил (C > U) в определенной позиции. Белок APOBEC1 способен осуществлять превращение C > U как в клетках в культуре, так и in vitro в одиночку, без дополнительных кофакторов. Авторы исследования собрали трехкомпонентный редактирующий комплекс, состоящий из белка оболочки фага MS2, связанного с гидовой РНК и с APOBEC1. В природе белок оболочки фага MS2 распознает особую шпильку в фаговом геноме. По этой причине в искусственной редактирующей системе к направляющей РНК, которая обеспечивает проведение дезаминазной реакции белком APOBEC1 строго в сайте-мишени, пришили фаговую шпильку, чтобы обеспечить ее узнавание белком MS2.
Ученые опробовали новую редактирующую систему на мРНК синего флуоресцентного белка (BFP), ген которого отличается от гена зеленого флуоресцентного белка (GFP) точечной заменой тимина на цитозин в позиции 199. Они работали с клетками линии HEK 293, стабильно экспрессирующими BFP, поэтому за результатами работы редактирующего комплекса можно было наблюдать с помощью конфокального микроскопа, оценивая изменение цвета флуоресцентного сигнала с синего на зеленый.
После подтверждения факта редактирования C > U с помощью микроскопии авторы работы проверили последовательности РНК в клетках, получивших редактирующий комплекс. Они провели ПЦР с обратной транскрипцией и обработали полученные фрагменты рестриктазой BtgI, которая узнает только последовательность неотредактированного BFP, но не GFP, после чего проанализировали полиморфизм длин полученных рестрикционных фрагментов. Почти 100% фрагментов, полученных в ходе ПЦР, были разрезаны BtgI, что указывает на высокую эффективность редактирования. Окончательно факт редактирования был подтвержден с помощью секвенирования по Сэнгеру. Для оценки побочных эффектов редактирования исследователи провели секвенирование тотальной РНК. Оказалось, что вне последовательностей-мишеней произошло около 6,7% замен C >U, что свидетельствует о хорошей точности нового редактора.
Авторы работы утверждают, что редактирование РНК подходит для терапевтических целей лучше, чем редактирование генома, поскольку, в частности, не приводит к непоправимым последствиям, и даже неверно отредактированная РНК будет разрушена в клетках. Они полагают, что созданный ими редактор РНК может найти применение для лечения болезней, обусловленных точечными заменами T > C.
Источник
Bhakta, S., Sakari, M. & Tsukahara, T. // RNA editing of BFP, a point mutant of GFP, using artificial APOBEC1 deaminase to restore the genetic code. // Scientific Reports, 2020, 10, 17304; DOI: 10.1038/s41598-020-74374-5.


 Меню
Меню





 Все темы
Все темы




 0
0








