Одобрен препарат на основе РНК-интерференции для лечения печеночной порфирии
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило препарат гивосиран компании Alnylam для лечения острой печеночной порфирии у взрослых. Это второй одобренный препарат, действие которого основано на РНК-интерференции.
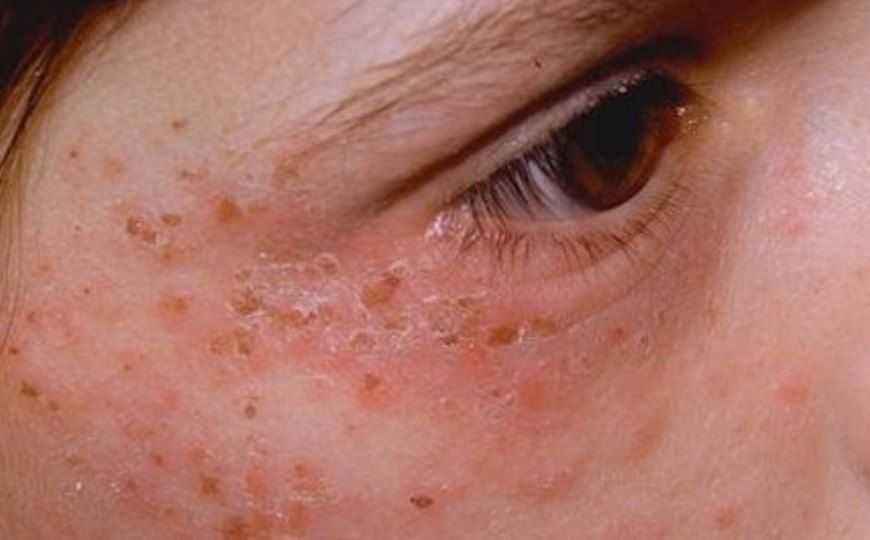
Острая печеночная порфирия — это наследственное заболевание, при котором в печени накапливаются предшественники гема — порфирины, что может приводить к боли, параличу, судорогам и другим осложнениям, требующим госпитализации. Причина болезни кроется в мутациях генов, включенных в путь биосинтеза гема.
Дельта-аминолевулиновая кислота является первичным компонентом синтеза всех гемов. Новый препарат гивосиран, одобренный FDA 20 ноября, нацелен на мРНК синтазы аминолевулиновой кислоты ALAS1: он уменьшает ее концентрацию, а также снижает уровень токсинов, вызывающих приступы острой порфирии. Препарат был принят после третьей стадии клинических испытаний ENVISION, которая представляет собой двойное слепое рандомизированное плацебо-контролируемое исследование. В испытании приняли участие 94 пациента из 18 стран, что делает его самым большим клиническим исследованием острой печеночной порфирии. У пациентов, получавших лекарства, приступы болезни проявлялись на 70% реже, чем у тех, кто принимал плацебо.
«До сегодняшнего дня лечение порфирии обеспечивало только частичное облегчение интенсивной неослабевающей боли, которая характерна для приступов болезни. Препарат, одобренный сегодня, способен уменьшить количество этих приступов», — говорит Ричард Паздур, директор Онкологического центра FDA.
Наиболее частыми побочными эффектами гивосирана оказались тошнота и иммунный ответ в месте инъекции. Одного испытуемого госпитализировали с анафилактическим шоком. Рекомендуются мониторинг аллергической реакции и функции почек пациента во время приема лекарства и проверка состояния печени перед его назначением.
Технология РНК-интерференции, на которой основано лечение, использует короткие нуклеотидные последовательности для уничтожения мРНК-мишени и прерывания трансляции. На сегодняшний день одобрено лишь два препарата, принцип действия которых основан на РНК-интерференции, и оба принадлежат компании Alnylam: ранее она выпустила препарат патисиран для лечения наследственного транстиретинового амилоидоза.

 Меню
Меню





 Все темы
Все темы



 0
0








