Определена структура полимеразы нового коронавируса
Построена трехмерная структура комплекса РНК-зависимой РНК-полимеразы SARS-CoV-2 с кофакторами nsp7 и nsp8. Моделирование взаимодействия полимеразы с ремдесивиром показало перспективность препарата для борьбы с COVID-19.
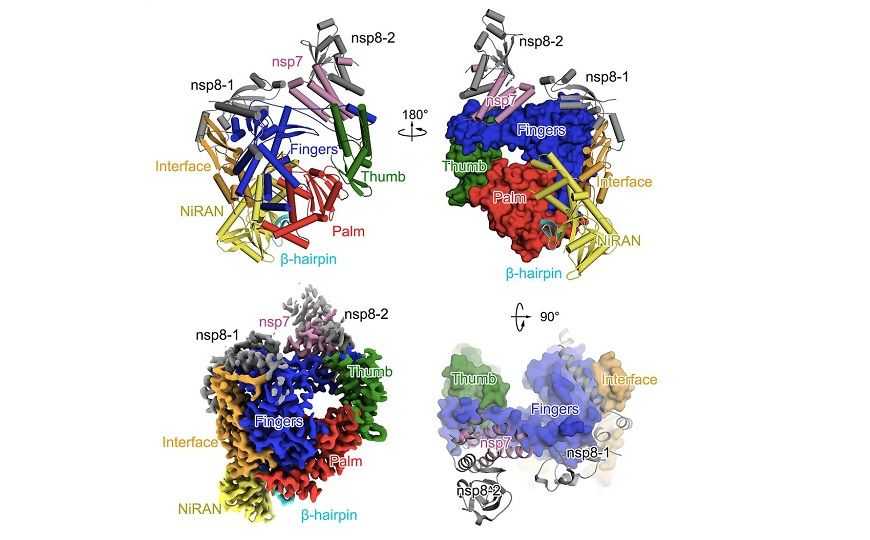
Credit: Yan Gao, et al., Science, 2020 | Creative Commons Attribution license
Репликация генома РНК-содержащих вирусов — это сложный процесс, на который можно специфически воздействовать. Группа ученых из Китая и Австралии с помощью криоэлектронной микроскопии расшифровала структуру комплекса РНК-зависимой РНК-полимеразы (RdRp или nsp12) с кофакторами nsp7 и nsp8 для SARS-CoV-2.
Полноразмерный белок nsp12 экспрессировали в E. coli, инкубировали с кофакторами, а затем выделяли и очищали полученный комплекс. С помощью криоэлектронного микроскопа ученые получили 7 994 снимка комплекса, результатом обработки которых стала 3D-реконструкция nsp12 в комплексе с nsp7 и nsp8 с шагом 2,9 Å.
Выяснилось, что РНК-полимераза SARS-CoV-2 содержит характерный для многих полимераз домен, напоминающий правую руку (аминокислотные остатки S367–F920) и уникальный для отряда Nidovirales (в этот отряд входят коронавирусы) N-концевой выступающий домен (остатки D60–R249), который повторяет архитектуру нидовирусной RdRp-ассоциированной нуклеотидилтрансферазы (NiRAN). Эти участки соединены поверхностным доменом (остатки A250–R365). Структура пары nsp7-nsp8 подобна структуре кофакторов полимеразы вируса атипичной пневмонии SARS-CoV.
Общая архитектура комплекса nsp12-nsp7-nsp8 SARS-CoV-2 сходна с архитектурой аналогичного комплекса SARS-CoV, однако обнаружены значительные различия в областях, обеспечивающих стабилизацию структуры.
Архитектура полимеразного домена SARS-CoV-2 характерна для вирусных РНК-полимераз. Активный сайт этого домена образован консервативными полимеразными мотивами A-G в субдомене ладони; его конфигурация подобна активным сайтам других РНК-полимераз. В частности, он содержит классический сайт связывания двухвалентных катионов в мотиве 611-TPHLMGWDYPKCDRAM-626.
Как и в других РНК-полимеразах, место для входа матрицы и нуклеозидтрифосфатов, а также пути выхода растущей цепи положительно заряжены и расположены в центральной полости, где происходит синтез РНК. Аналогичные структуры описаны для РНК-полимеразы SARS-CoV, вируса гепатита С и полиовируса.
Ремдесивир — синтетический нуклеотидный аналог — рассматривается как ингибитор синтеза РНК у SARS-CoV-2. Действенность блокаторов синтеза нуклеотидной цепи зависит от того, насколько эффективно вирусные полимеразы распознают и включают активную форму ингибиторов в растущую нить РНК. Ученые смоделировали взаимодействие ремдесивира с nsp12 и показали, что ремдесивир связывается с тем же участком полимеразы, с которым связывается нуклеозид. Предложенная модель может работать и для других нуклеотидных аналогов.
Кроме того, авторы считают, что РНК-зависимая РНК-полимераза SARS-CoV-2 — отличная мишень для новых препаратов. Доступность структуры полимеразы поспособствует их разработке.

 Меню
Меню





 Все темы
Все темы




 0
0








