Органоиды из клеток пациентов предскажут эффективность противораковой терапии
Ученые из Китая вырастили in vitro органоиды из раковых клеток пациентов, воспроизводящие гистологические и генетические особенности первичных опухолей. Всего исследователи получили 64 линии органоидов, на которых протестировали 301 лекарственный препарат. Это позволило выявить прогностические маркеры восприимчивости опухолей к различным препаратам.
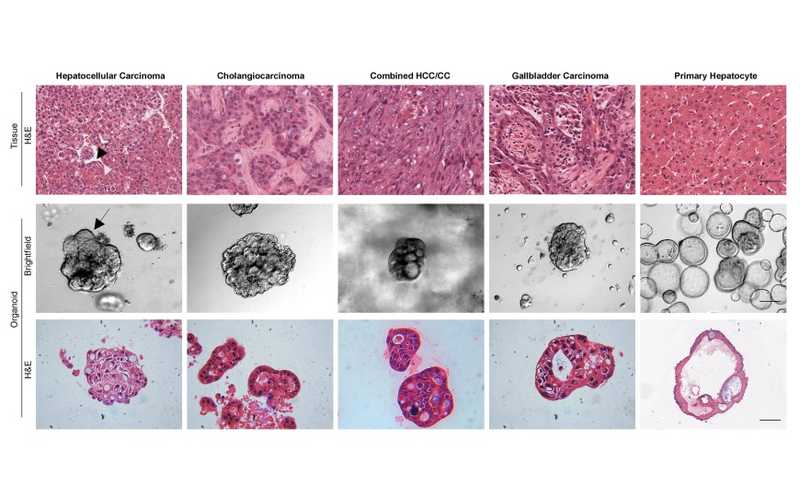
Гистология первичных гепатобилиарных опухолей и тканей здоровой печени, а также микроскопия и гистологическое окрашивание линий органоидов, полученных из них.
Credit:
Cell Reports Medicine (2024). DOI:
10.1016/j.xcrm.2023.101375 |
CC BY-NC-ND
Гепатобилиарные опухоли — четвертая по значимости причина смерти от рака в мире. Они включают более 20 подтипов, которые различаются генетически, морфологически и клинически, что затрудняет подбор оптимальной стратегии лечения. Ученые из Китая вырастили органоиды из опухолевых клеток, полученных от пациентов, и показали, что эти органоиды повторяют гистологические и молекулярные особенности первичных опухолей. Кроме того, с помощью полученных органоидов исследователи протестировали более 300 препаратов и определили прогностические маркеры, способные предсказать эффективность терапии.
В первую очередь авторы работы создали биобанк из 64 линий органоидов, полученных из гепатобилиарных опухолей пациентов. Они получили 46 органоидов из гепатоцеллюлярной карциномы (ГЦК), 8 — из внутрипеченочной холангиокарциномы (ВПХ), 4 — из комбинированной гепатоцеллюлярной холангиокарциномы (КГХК), 4 — из рака желчного пузыря (РЖП), 1 — из внутригрудной холангиокарциномы (ВГХК) и 1 — из метастатического рака толстой кишки.
Изолированные клетки опухолей высевали на матригель в качестве внеклеточного матрикса и культивировали в питательной среде, содержащей факторы роста фибробластов, гепатоцитов, эпидермальный фактор роста и другие биологически активные соединения. После длительного культивирования полученные органоиды сохраняли морфологию, а некоторые линии обладали чертами, характерными для тех видов рака, из которых были получены. В частности, органоиды, полученные из ГЦК или ХГХК, имели солидные или компактные структуры, из ВПХ — кистоподобные структуры неправильной формы, из РЖП — трубчатые и железистые структуры. Эти особенности совпадали с гистопатологическими характеристиками соответствующих опухолей. Также в образцах выявлялись биомаркеры гепатобилиарных опухолей: альбумин, альфа-фетопротеин, HepPar1 и другие, причем эти биомаркеры были специфичны для опухолевых подтипов.
Затем авторы сравнили генетические профили выращенных органоидов и первичных тканей пациентов. Полногеномное секвенирование показало, что органоиды повторяют разнообразный геномный ландшафт первичных гепатобилиарных опухолей, включая изменение числа копий генов и мутационную нагрузку. Вирус гепатита B (HBV), как известно, может встраиваться в геном и способствовать его нестабильности и гепатоканцерогенезу. Исследование показало, что в органоидах были те же точки интеграции HBV в геном, что и в первичных тканях.
Ученые провели транскриптомный анализ 53 линий органоидов. С помощью анализа главных компонентов и неконтролируемой кластеризации на основе 2000 наиболее вариабельных генов исследователи выделили три группы органоидов. Первая из них характеризовалась увеличением количества пролиферативных генов, таких как TOP2A, MKI-67, CCNB1 и CCND3, и демонстрировала функциональное обогащение путей, связанных с пролиферацией. Вторая группа характеризовалась самым высоким уровнем генов, связанных с метаболизмом, таких как ADH1A, G6PC, CYP3A и CYP2E1. Третья группа демонстрировала специфическую экспрессию генов, связанных с воспалением и иммунитетом, таких как ITGB1, CD44, CD82, LAMB3 и AGRN, преимущественно регулирующих клеточную адгезию и опухолевый иммунитет.
Чтобы оценить органоиды как функциональные модели заболеваний, авторы использовали их для скрининга чувствительности к лекарственным препаратам. Всего они протестировали 301 соединение, в том числе 36 противораковых препаратов, 36 средств эпигенетической терапии и 229 соединений, нацеленных на двадцать ключевых метаболических путей онкогенеза. Органоиды, содержащие клетки из разных опухолей, по-разному реагировали на препараты, причем разница наблюдалась даже между линиями в пределах одной группы. Реакция на соединения зависела от механизма действия препарата.
Ученые выявили связь между применяемым лекарственным препаратом и экспрессией генов в органоидах. Они обнаружили уже известные значимые ассоциации с изменениями в NF1, AGRN и SETDB1 и других генах. Кроме того, мутация промотора RUNX1 оказалась связана с чувствительностью к препарату. Также исследователи определили прогностические признаки эффективности лекарственных препаратов для лечения гепатобилиарных опухолей.
Таким образом, ученым удалось вырастить органоиды из опухолевых клеток пациентов, причем эти органоиды повторяли их гистологические и генетические особенности самих опухолей. С помощью полученных органоидов исследователи выявили прогностические маркеры восприимчивости гепатобилиарных опухолей к тем или иным препаратам. Предложенный подход может быть использован в персонализированной медицине при подборе оптимальной стратегии терапии рака.
Биопечать опухолевых органоидов поможет быстро выявить чувствительность к лекарствам


 Меню
Меню





 Все темы
Все темы



 0
0