Патогены полости рта повышают агрессивность оральных опухолей
Ученые из США и Египта показали, что патогены полости рта способны усиливать процессы миграции, инвазии клеток опухоли и формирования опухолевых сфер при плоскоклеточном раке полости рта, и описали лежащие в основе молекулярные механизмы. Эти процессы можно подавить, используя антимикробный пептид низин.
Credit: Pachiyappan Kamarajan, et al., 2020; DOI: 10.1371/journal.ppat.1008881 | CC BY 4.0
Плоскоклеточный рак ротовой полости составляет 90% злокачественных образований полости рта и характеризуется низкой пятилетней выживаемостью. Факторами риска считаются курение, употребление алкоголя и инфицирование вирусом папилломы человека (ВПЧ). Однако эти факторы не объясняют агрессивность этого типа рака. Группа ученых под руководством доктора Ивонны Капила, профессора Калифорнийского университета в Сан-Франциско, показала, что развитию агрессивного рака способствуют патогены полости рта.
Ранее существовали предположения, что антимикробные пептиды, или бактериоцины, имеют цитотоксический эффект в отношении раковых клеток. В предыдущем исследовании эта же научная группа показала, что антимикробный пептид низин (широко использующийся пищевой консервант Е234) блокирует онкогенез плоскоклеточного рака полости рта и увеличивает продолжительность жизни модельных мышей с такими опухолями.
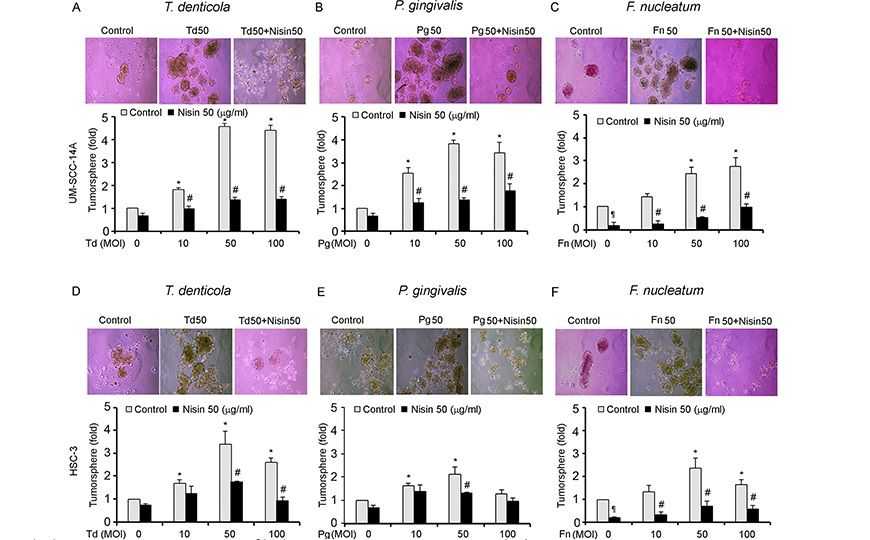
В новой работе исследователи изучали вклад в онкогенез некоторых патогенов, ассоциированных с различными заболеваниями полости рта. Эксперименты проводились на культуре клеток плоскоклеточного рака ротовой полости. К клеткам добавлялась среда, содержащая патогенные оральные бактерии Treponema denticola, Porphyromonas gingivalis или Fusobacterium nucleatum, или контрольная среда без бактерий. Затем измерялось расстояние, на которое мигрировали раковые клетки, а также их способность проникать сквозь искусственную мембрану, моделирующую клеточный матрикс. Выяснилось, что все три патогена значительно увеличивали миграцию и инвазию раковых клеток. В то же время низин дозозависимо подавлял эти процессы. При этом обработка клеток опухоли бактериями-комменсалами полости рта (Streptococcus gordonii, Streptococcus salivarius, Veillonella parvula) не влияла на миграцию клеток. Любопытно, что P. gingivalis в высоких концентрациях индуцировал апоптоз у клеток орального рака. Другие использовавшиеся в работе патогены такого эффекта не оказывали.
Ученые также показали, что все три патогена усиливают формирование опухолевых сфер. Низин подавлял и этот эффект.
Известно, что центральную роль в миграции клеток орального плоскоклеточного рака играет интегрин альфа-V, экспрессия которого приводит к активации киназы FAK. Исследователи обнаружили, что в присутствии патогенов экспрессия интегрина альфа-V клетками опухоли усиливается, а воздействие одной T. denticola повышает активность FAK. Низин же снижает экспрессию интегрина альфа-V, подавляя миграцию клеток. На мышиной модели плоскоклеточного рака полости рта было подтверждено, что патогенные бактерии усиливают агрессивность рака in vivo, а низин уменьшает рост опухоли.
Авторы считают, что их наблюдения могут задать новую парадигму лечения опухолей, основанную на использовании антимикробных препаратов.
Источник
Pachiyappan Kamarajan, et al. // Periodontal pathogens promote cancer aggressivity via TLR/MyD88 triggered activation of Integrin/FAK signaling that is therapeutically reversible by a probiotic bacteriocin. // PLoS Pathogens, Published: October 1, 2020; DOI: 10.1371/journal.ppat.1008881


 Меню
Меню





 Все темы
Все темы




 0
0








