Показана роль белка XPG в регуляции механизма репарации ДНК
Ученые из Саудовской Аравии и США выяснили, как на молекулярном уровне происходит регуляция эксцизионной репарации нуклеотидов — механизма восстановления повреждений одной цепи ДНК. Оказалось, что транскрипционный фактор TFIIH действует в комплексе с нуклеазой XPG. Сначала XPG стимулирует расплетание ДНК и перемещение комплекса по одной из цепей в поисках повреждения, затем TFIIH стимулирует вырезание поврежденного участка за счет активности XPG.
Один из механизмов репарации ДНК, эксцизионная репарация нуклеотидов (nucleotide excision repair, NER), имеет решающее значение для восстановления повреждений одной цепи ДНК, вызванных УФ-облучением, мутагенами, химиотерапевтическими препаратами и другими факторами. При этом в качестве матрицы используется неповрежденная комплементарная цепь. С мутациями в белках системы NER связаны более 10 заболеваний. Кроме того, реализация механизма NER препятствует лечению рака, так как она обеспечивает восстановление повреждений ДНК в клетках опухоли во время лучевой терапии, поэтому актуальным является поиск биологически безопасного ингибитора NER. Однако чтобы разработка такого ингибитора стала возможна, необходимо детально изучить молекулярный механизм этого процесса. В новой работе ученые из США и Саудовской Аравии описали функцию белка XPG.
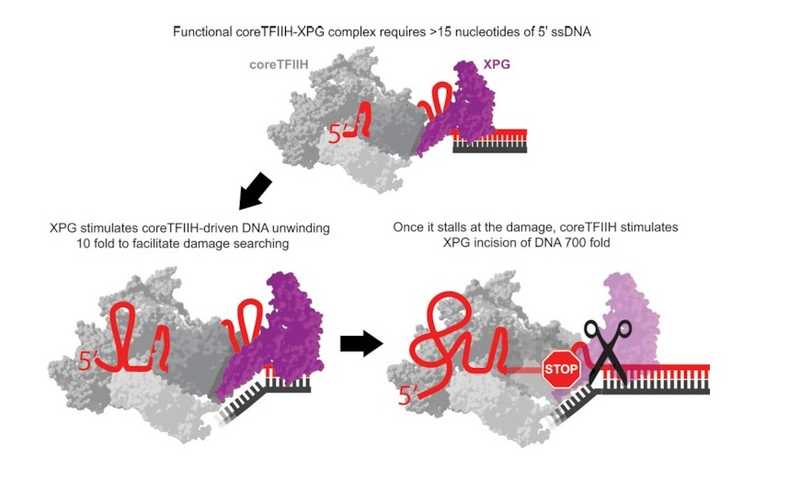
Во время NER после первичной детекции поврежденных фрагментов ДНК к работе приступает транскрипционный фактор TFIIH. Комплекс TFIIH состоит из центральной части (или сердцевины, coreTFIIH) и циклин-активируемого киназного модуля. CoreTFIIH сформирован семью субъединицами, включая АТФазы XPB и XPD. XPB отвечает за расплетание нитей ДНК с образованием пузыря, а XPD сканирует повреждения. В самом начале своей работы TFIIH рекрутирует нуклеазу XPG, но действует эта нуклеаза в последнюю очередь — она надрезает поврежденную цепь ДНК с 3'-конца. При этом для запуска NER важно присутствие, но не каталитическая активность XPG.
С помощью флуоресцентной визуалиации единичных молекул авторы новой работы определили скорость перемещения coreTFIIH вдоль одноцепочечной ДНК (оцДНК) и раскручивания им двухцепочечной ДНК (дцДНК) в присутствии других белков, вовлеченных в NER. Эксперименты проводились на бесклеточной системе. Ученые показали, что XPG не влияет на скорость какого-либо из двух процессов, но увеличивает вероятность переключения с перемещения вдоль оцДНК на расплетание дцДНК на границе этих двух типов ДНК. Сам по себе coreTFIIH не мог с достаточной эффективностью раскручивать дцДНК, то есть присутствие XPG необходимо для начала образования пузыря при NER.
Далее ученые провели анализ ферментативной активности комплекса coreTFIIH-XPG. Во время перемещения вдоль ДНК нуклеазная активность XPG подавлялась. Ингибирование движения coreTFIIH, которое достигалось удалением из системы АТФ или добавлением ее негидролизуемого аналога, стимулировало нуклеазную активность XPG в отношении неповрежденных участков. Если же coreTFIIH останавливался при встрече с поврежденным участком, нуклеаза XPG срабатывала даже в присутствии АТФ. Следовательно, разрезание ДНК вызывает не столько встреча с повреждением сама по себе, сколько прекращение или нарушение гидролиза АТФ. Ученые предположили, что гидролиз АТФ регулируется субъединицей XPD, причем ранее высказывалось предположение, что XPD взаимодействует напрямую с XPG.
Примечательно, что как хеликазная, так и нуклеазная активность coreTFIIH-XPG зависела от длины расплетенного фрагмента ДНК. Оптимальной была длина, равная примерно 15–20 нуклеотидам, — это «правильный» размер пузыря, при достижении которого происходит разрезание поврежденного участка с 3'-конца и его удаление.
Таким образом, ученые продемонстрировали последовательную регуляцию NER комплексом coreTFIIH-XPG. Схема работы комплекса представлена на иллюстрации.
Журнал Nucleic Acids Research назвал публикацию «прорывной статьей». «Эти результаты раскрывают фундаментальный механизм контроля NER и указывают на взаимодействие между TFIIH и XPG как на эффективную мишень для терапии», — говорит один из руководителей работы Самир Хамдан, сотрудник Научно-технологического университета имени короля Абдаллы (Саудовская Аравия).
Источник
Bralic A., et al. A scanning-to-incision switch in TFIIH-XPG induced by DNA damage licenses nucleotide excision repair // Nucleic Acids Research. 2022. gkac1095. DOI: 10.1093/nar/gkac1095


 Меню
Меню





 Все темы
Все темы




 0
0








