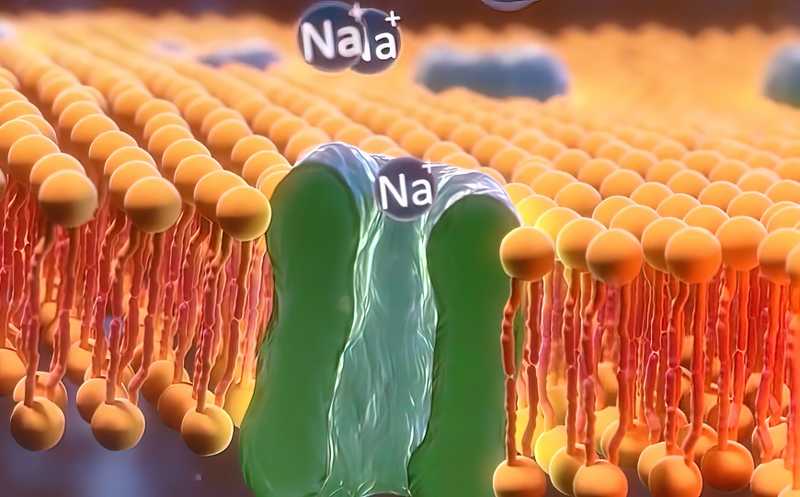
Показана роль натриевого канала TRPM4 в активации некроза опухоли
Некоторые современные противоопухолевые терапии направлены на запуск некроза в раковых клетках. В отличие от апоптоза, этот процесс активирует иммунный ответ. Ученые из Университета Иллинойса впервые определили, как медицинские препараты индуцируют некроз в опухоли. Оказалось, что важную роль в этом играет селективный натриевый канал TRPM4, который обеспечивает набухание клетки и разрыв клеточной мембраны из-за осмотического стресса.
При лечении солидных опухолей иммунотерапию часто используют совместно с цитотоксическими соединениями, которые должны активировать иммунитет. Однако чаще всего такая комбинация запускает апоптоз, который не привлекает внимания иммунных клеток. В качестве альтернативы в опухолевой ткани можно запустить некроз. Соединения с таким эффектом уже известны, но пока не до конца понятно, как они действуют.
Ученые из Университет Иллинойса (США) установили, как подобные вещества ведут к клеточной гибели. Для этого они обработали клетки рака молочной железы двумя соединениями, BHPI и ErSO, которые вызывают некроз опухоли. Сначала авторы провели скрининг с помощью системы CRISPR/Cas9. В ходе эксперименте в клетках «выключали» гены по одному, после чего на них воздействовали препаратом. Если какие-то клетки не реагировали на лечение, то «выключенный» ген играл важную роль в механизме терапии. С помощью этого метода ученые идентифицировали ген TRPM4, который кодирует селективный натриевый канал.
Затем ученые сравнили эффект нокаута TRPM4 на нескольких клеточных линиях. Они подтвердили, что после нокаута клетки перестают реагировать на терапию, а при восстановлении его функции запускается некроз. Так как в норме внутри клетки меньше натрия, чем снаружи, исследователи предположили, что BHPI и ErSO активируют ионный канал и способствуют разбуханию клетки. Чтобы это доказать, они продемонстрировали, что в интактных клетках, в отличие от нокаутных, после добавления препаратов повышается уровень внутриклеточного натрия.
Авторы предполагают, что ErSO индуцирует двухступенчатый процесс. На первом этапе происходит быстрое разбухание клетки, тут важную роль играет TRPM4. В результате лопается мембрана, многие клетки погибают. Одновременно происходит активация ответа на несвернутые белки (unfolded protein response, UPR), поддерживаемого длительное время. Это приводит к гибели оставшихся клеток. Интересно, что в клетках с нокаутом TRPM4 блокируется не только быстрая клеточная гибель, но ингибирование пролиферации через четыре дня. Тот же результат показали на мышиной модели с ксенографтами. Должно быть, TRPM4 важен не только для быстрой клеточной гибели, вызванной ErSO, но и для длительной активации UPR. Дополнительные опыты позволили предположить, что ErSO вызывает изначальную активацию UPR, а разбухание клетки и осмотический стресс поддерживает ее.
Исследователи проверили, смогут ли другие вещества, приводящие к набуханию клеток и дефициту АТФ независимым от TRPM4 образом, воспроизвести эффект ErSO. Они использовали альтернативные агенты — иономицин (активирует UPR) и 2-деоксиглюкозы (снижает уровень АТФ). Иономицин в одиночку убивал опухолевые клетки дикого типа и нокаутные клетки. Комбинация препаратов имела синергический эффект. Важная роль TRPM4 была показана и при других терапиях рака, связанных с некрозом.
Ученые продемонстрировали, что от TRPM4 зависит активация иммунных клеток. В нокаутных клетках не происходит выброса в окружающую среду молекул, связанных с некрозом, таких как АТФ. Среда, в которой выращивали интактные клетки, обработанные ErSO, но не нокаутные клетки, активировала макрофаги — в них повышалась экспрессия мРНК провоспалительных цитокинов. Такая среда также индуцировала миграцию иммунных клеток.
Источник:
Ghosh S., et al. Plasma Membrane Channel TRPM4 Mediates Immunogenic Therapy-Induced Necrosis. // Cancer Res. 2023 DOI: 10.1158/0008-5472.CAN-23-0157








 Меню
Меню





 Все темы
Все темы






 0
0