Полимер-протеомиметик защищает митохондрии при болезни Гентингтона
При болезни Гентингтона мутантный гентингтин начинает взаимодействовать с новыми белками, например, с VCP, который перемещается в митохондрии и провоцирует митофагию. Пептид HV3 препятствует такому взаимодействую, но период полувыведения этого пептида из организма — всего пять минут. Исследователи из США разработали белок-подобный полимер, который увеличивает период полувыведения пептида в 2000 раз, «спасая» митохондрии и нейроны и улучшая двигательную активность мышей, моделирующих болезнь.
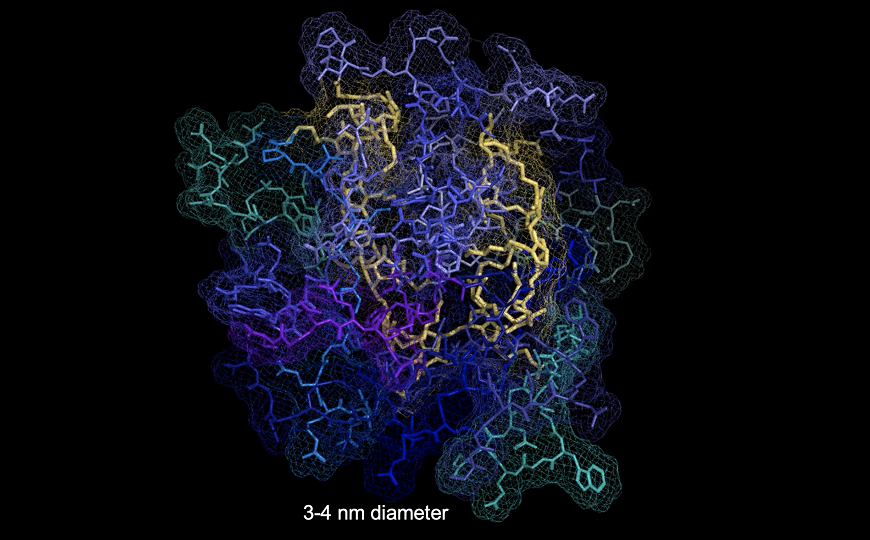
Полимер окрашен желтым, активные пептиды – синим и зеленым.
Credit:
Nathan Gianneschi/Northwestern University | Пресс-релиз
Болезнь Гентингтона — это генетическое нейродегенеративное заболевание, вызванное экспансией повторов CAG в гене, кодирующем белок гентингтин (Htt), что приводит к нарушению его структуры и образованию белковых агрегатов. Точная функция гентингтина неизвестна, хотя он участвует в эмбрио- и нейрогенезе. Мутантный гентингтин начинает взаимодействовать с новыми белками, например, с белком VCP. В результате этого взаимодействия VCP перемещается в митохондрии, что запускает митофагию.
Чтобы предотвратить взаимодействие между мутантным Htt (mtHtt) и VCP, ранее уже предлагалось использовать пептид HV3 (HVLVMCAT). Сам по себе он плохо проникает в клетки, но при его слиянии с пептидом TAT, полученным из ВИЧ, блокирует взаимодействие между mtHtt и VCP и «спасает» митохондрии. Тем не менее, период полувыведения этого пептида из организма — всего пять минут. Ученые из США придумали способ повысить стабильность этого пептида, использовав в качестве платформы-носителя белок-подобные полимеры (PLP).
PLP состоят из гидрофобного полимерного скаффолда, где в качестве гидрофильных боковых цепочек используются пептиды. Благодаря такой структуре PLP образуют глобулы, способные проникать в клетки и более устойчивые к различным воздействиям. Исследователи получили PLP, содержащие пептиды HV3, но для облегчения проникновения в клетки в их последовательность также внесли несколько положительно заряженных аминокислот — аргининов или лизинов.
Полученные PLP сначала протестировали in vitro на клеточной линии HdhQ111 — иммортализованных мышиных нейронах, содержащих в гене Htt человеческий экзон 1 с 111 повторами CAG. Клетки сначала лишали сыворотки, а потом добавляли либо пептид HV3-TAT, либо PLP. В обоих случаях выживаемость клеток значительно повысилась. На клетках HEK293T, в которые внесли полноразмерный человеческий Htt с 73 повторами CAG, авторы также показали, что и пептид HV3-TAT, и PLP способны нарушать взаимодействие между mtHtt и VCP.
С помощью флуоресцентного окрашивания ученые подтвердили, что PLP может проникать в клетку. Для этого пептид HV3-TAT и PLP пометили флуоресцентным красителем родамином и наблюдали его накопление в клетке. При этом PLP накапливался в больших количествах и находился в клетке вплоть до семи суток, тогда как интенсивность флуоресценции пептида постепенно падала. Затем митохондрии окрасили MitoTracker и наблюдали в них сигналы от меченых HV3-TAT и PLP. Исследователи также показали, что после обработки пептидом и PLP значительно снижается число фрагментированных митохондрий, и это предотвращает гибель нейронов.
Исследователи подтвердили данные в экспериментах на трансгенных мышах R6/2, которые экспрессируют фрагмент человеческого Htt. PLP вводили мышам подкожно в дозировке 1,69 мг/кг в сутки в течение семи недель, при этом использовалось два вида контролей — трансгенных мышей, которым вводили физраствор, и мышей дикого типа, которым вводили PLP или физраствор. У трансгенных мышей, которым вводили физраствор, со временем значительно нарушалась подвижность, в том числе они меньше передвигались в тесте на открытом поле. При лечении таких мышей PLP нарушения уменьшались.
В средних шипиковых нейронах полосатого тела, которые сильнее всего затрагивает болезнь Гентингтона, у трансгенных мышей, которых лечили PLP, повысились уровни белков DARPP-32, PSD95, BDNF. DARPP-32 служит маркером таких нейронов, BDNF необходим для их выживания, а PSD95 — это маркер синапсов. На основе этих результатов ученые заключили, что в результате лечения им удалось «спасти» нейроны полосатого тела. Также в полосатом теле значительно снизилось число агрегатов mtHtt, а VCP меньше накапливался в митохондриях.
Ученые провели еще ряд доклинических тестов PLP. Они выяснили, что, по сравнению с исходным пептидом HV3-TAT, протеомиметик, содержащий этот пептид, гораздо устойчивее к протеазам (пепсину, трипсину, хемотрипсину, эластазе и проназе) и к микросомам печени. Введение PLP не влияет на гемолиз крови и не способствует активации системы комплемента.
Чтобы изучить фармакокинетику и биораспределение препарата, PLP пометили гадолинием перед введением его в хвостовую вену мышей дикого типа в довольно большой концентрации — 5,54 мг/кг. Период полувыведения препарата оказался в 2000 раз выше, чем у свободного пептида. Если HV3-TAT распадался в течение пяти минут после введения в организм, то период полувыведения PLP составил 152 часа. При этом большая часть препарата накапливалась в печени и почках, но также он детектировался и в мозге, в частности, в полосатом теле и в коре — именно эти отделы мозга наиболее сильно затрагивает болезнь Гентингтона. Несмотря на это, через пять минут после введения препарата его концентрация в мозге составляла всего 0,6 мкг/г, что указывает на необходимость в повторных дозах PLP. Вместе с тем введение препарата в течение двух месяцев не имело значимого токсического эффекта.
Таким образом, исследование показало преимущества протеомиметиков перед пептидами. В частности, такие полимерные платформы могут таргетировать внутриклеточные мишени, а не только внеклеточные, как, например, антитела. В будущем авторы намерены оптимизировать структуру PLP, чтобы улучшить его проникновение в мозг через гематоэнцефалический барьер, а также протестировать его действие на нейронах, полученных из индуцированных плюрипотентных стволовых клеток человека.
Агрегаты белка гентингтина нарушают целостность ядерной оболочки
Источник:
Choi W., et al. Proteomimetic polymer blocks mitochondrial damage, rescues Huntington’s neurons, and slows onset of neuropathology in vivo. // Science Advances (2024). DOI: 10.1126/sciadv.ado8307


 Меню
Меню





 Все темы
Все темы



 0
0