Праймированное редактирование сохранило зрение мышам
Китайские ученые использовали систему для праймированного редактирования, содержащую никазу Cas9 со сниженными требованиями к мишени, для коррекции мутации, ассоциированной с пигментным ретинитом, у модельных мышей. Редактирование предотвратило гибель фоторецепторов и, соответственно, потерю зрения.
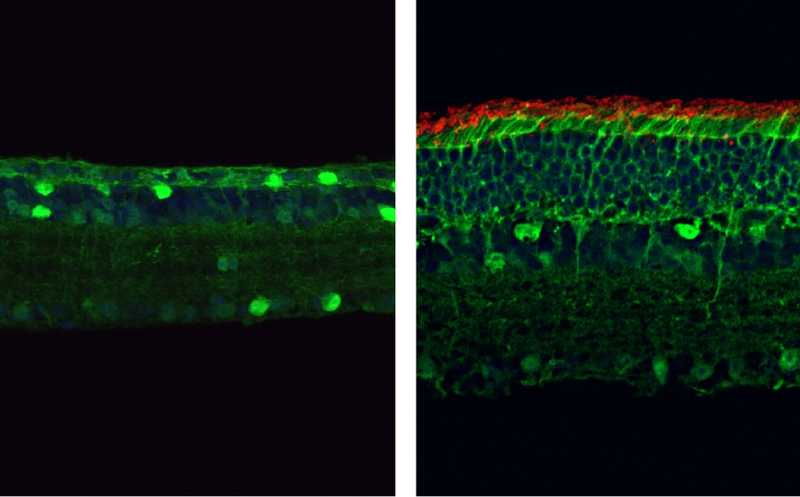
Credit: © 2023 Qin et al. Originally published in Journal of Experimental Medicine. https://doi.org/10.1084/jem.20220776 | Пресс-релиз
Пигментный ретинит — это наследственное заболевание, для которого характерна прогрессирующая дегенерация сетчатки, в конце концов приводящая к слепоте. На сегодня ассоциации с пигментным ретинитом описаны для мутаций в более чем ста генах. Одной из перспективных стратегий борьбы с этим заболеванием считается таргетное редактирование мутаций. В новой работе китайские ученые предложили лечить пигментный ретинит, обусловленный мутацией в гене бета-субъединицы фосфодиэстеразы (PDE6b), с помощью праймированного редактирования (PE). Этот фермент необходим для инициации фототрансдукции в палочках сетчатки.
Ученые использовали никазу SpRY — вариант нуклеазы Cas9 Streptococcus pyogenes, действие которого почти не зависит от наличия особого нуклеотидного мотива возле мишени (PAM), а потому его можно направить на бо́льшее количество последовательностей. На основе SpRY сконструировали химерный белок PESpRY: никазу сшили с обратной транскриптазой инженерного вируса мышиной лейкемии Молони. Принцип действия такой системы PE следующий: гидовая РНК (обозначается как pegRNA в случае PE) не только направляет PESpRY к сайту-мишени, но также служит матрицей, кодирующей «правильную» последовательность. В таргетном сайте никаза в составе PESpRY вносит разрыв, а обратная транскриптаза застраивает его, используя РНК-матрицу. Таким образом в геном вносится желаемая модификация.
Сначала систему PESpRY протестировали на культуре мышиных нейронов Neuro2a с мутацией Pde6brd10 — заменой аргинина на цистеин в позиции 560. У мышей с такой мутацией дегенерация сетчатки начинается на 16-й день после рождения: сначала отмирают палочки, затем происходит вторичная гибель колбочек, и к 60-му дню после рождения во внешнем зернистом слое сетчатки остается только один слой фоторецепторных ядер.
На культуре клеток ученые попробовали обратить мутацию Pde6brd10 с помощью однонуклеотидной замены (T на C), внести двойную замену (TGC на AGA), сохраняющую аминокислотный состав дикого типа, а также внести комбинированную модификацию в мутантный локус (инсерция AC плюс замена T на C). Эффективность редактирования оценивали с помощью высокопроизводительного секвенирования. Она зависела от гидовой РНК, размера и последовательности матрицы для обратной транскриптазы. После оптимизации всех параметров эффективность работы PESpRY достигла 63,76 ± 0,94% для однонуклеотидной замены, 55,24 ± 1,14% для двойной замены и 55,46 ± 1,30% для комбинированной модификации. Частота инделов не превышала 0,2%. Такие результаты говорят о потенциальной применимости PESpRY для редактирования гена PDE6b.
Затем ученые проверили PESpRY на модельных мышах с той же мутацией. Для доставки системы редактирования использовали два AAV-вектора: один кодировал собственно PESpRY, второй — гидовую РНК, сшитую с последовательностью репортерного белка. Векторы вводили субретинально на 14-й день после рождения (контрольные мыши не получали гидовой РНК). Эффективность трансдукции оценивали на 35-й и 120-й дни жизни мышей. Количество клеток сетчатки, экспрессирующих репортерный белок, составляло 54,05 ± 0,82% и 45,95 ± 0,66%, соответственно. Частота редактирования для замены T на C достигала 76,34 ± 1,10%, для двойной замены (TGC на AGA) — 69,92 ± 0,9% (комбинированная модификация in vivo не тестировалась). В результате редактирования восстанавливалась экспрессия PDE6β — к 60-му дню после рождения она достигала 75% от нормы, а холофермент PDE сохранял активность.
Дальнейший анализ подтвердил присутствие палочек и колбочек в отредактированной сетчатке. Толщина внешнего ядерного слоя сетчатки у отредактированных мышей была близка к таковой у мышей дикого типа.
Наконец, электроретинография и поведенческие тесты показали, что коррекция мутации Pde6brd10 с помощью PESpRY позволила сохранить функции сетчатки и зрение мышей.
Таким образом, исследование продемонстрировало применимость PESpRY для терапевтического редактирования генома in vivo. Авторы отмечают, что теперь предстоит большая работа по проверке безопасности и эффективности подходя для людей.
Источник
Qin, et al. Vision rescue via unconstrained in vivo prime editing in degenerating neural retinas. // Journal of Experimental Medicine, (2023) 220 (5): e20220776. DOI: 10.1084/jem.20220776


 Меню
Меню





 Все темы
Все темы




 0
0