Предложен механизм развития тромбозов после аденовирусных вакцин
Редкие случаи тромботических осложнений после вакцины AstraZeneca против коронавируса широко обсуждались. Авторы нового исследования установили, что аденовирусный вектор может связываться с тромбоцитарным фактором 4. После этого в крови появляются антитела против PF4, которые, в свою очередь, связываются с тромбоцитами и активируют их. Таким образом, причина оказалась не в примесях к основному компоненту, а в нем самом.
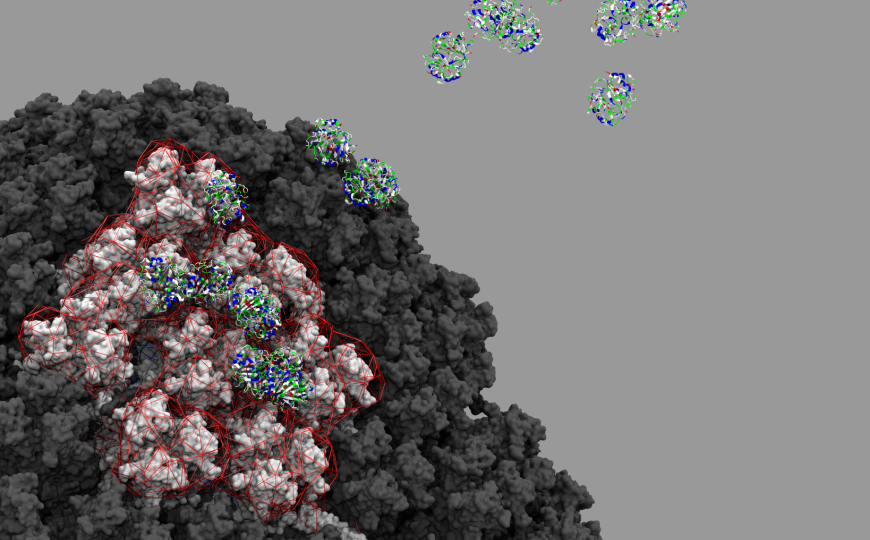
Исследователи из Аризонского университета (США), Кардиффского университета (Великобритания) и других научных центров продемонстрировали, что все три аденовирусных вектора, используемые в вакцинах против SARS-CoV-2 — человеческие аденовирусы Ad5, Ad26, ChAdOx1, полученный из аденовируса шимпанзе Y25 — связываются с тромбоцитарным фактором 4 (PF4). Известно, что этот белок участвует в развитии иммунной тромбоцитопении.
Вакцины на основе аденовирусных векторов против коронавируса — это ChAdOx1-nCoV-19 от AstraZeneca, также известная как AZD1222/Vaxzevria, вакцина компании Johnson&Johnson и отечественный «Спутник V». После иммунизации этими вакцинами зафиксированы крайне редкие случаи иммунной тромбоцитопении и тромбозов, некоторые с летальными исходами. В том числе описаны случаи тромбоза венозных синусов головного мозга, тромбозов воротной, чревной или печеночной вен, тромбоэмболия легочной артерии. Что касается вакцины AstraZeneca, речь идет о единичных случаях тромбозов на сотни тысяч. В Аргентине было зарегистрировано два случая тромбоцитопении на 3 400 000 инъекции «Спутник V», в России такие случаи пока не отмечены, в том числе в чате народных отчетов о вакцинации.
Наиболее обоснованная гипотеза, объясняющая это осложнение, предлагает механизм, аналогичный гепарин-индуцированной тромботической тромбоцитопении (ГИТТ). При ГИТТ образуется комплекс между положительно заряженным тромбоцитарным фактором 4 (PF4) и отрицательно заряженной молекулой гепарина. К этому комплексу образуются антитела; комплекс антитела с тромбоцитарным фактором и гепарином адсорбируется на мембране тромбоцитов, способствует их активации и тромбообразованию. (Это ГИТТ 2 типа; существует еще и ГИТТ 1 типа, когда гепарин взаимодействует с мембраной тромбоцита напрямую.)
Осложнение после вакцинации по аналогии назвали вакцино-индуцированной иммунной тромботической тромбоцитопенией (ВИТТ), действительно, анализы при этом синдроме показывают антитела к PF4. Предполагалось, что PF4 образует комплекс с неким компонентом вакцины, возможно, полианионной природы, например, с ДНК из клеток, в которых выращивали аденовирусы, или примесные белки. Это объясняло, почему тромбозы при вакцинации «Спутником» встречаются на два порядка реже: «Спутник» производится с более высокой степенью очистки.
(Предположение о том, что тромбозам способствует S-белок, который вырабатывается в организме после вакцинации, причем механизм аналогичен COVID-19, не выдерживает критики. Во-первых, цитокиновый шторм и тромбозы при COVID-19 вызывает целый вирус, но не один белок, во-вторых, при вакцинации в кровоток могут попасть лишь ничтожные количества S-белка. Сам вектор S-белка не содержит, в нем присутствует только его ген. Клетки, в которые проникли векторы, презентируют белок на своей поверхности, продолжается это недолго, и в крови обнаруживаются только незначительные количества S1-субъединицы. И наконец, в третьих: субъединичные вакцины, которые содержат S-белок, как раз не вызывают тромбозов.)
Чтобы понять, не связаны ли осложнения с самим вектором, авторы новой статьи изучили взаимодействие вакцинных векторов с белками хозяина. Они охарактеризовали структуру капсида ChAdOx1 и его рецептор, отвечающий за первичное взаимодействие с клеткой во время инфекции, с разрешением 3,07 Å. Затем оценили способность взаимодействовать с потенциальными партнерами, включая клеточные рецепторы CD46 и CAR, а также PF4. Полученные результаты авторы подтвердили с помощью экспериментов на клетках in vitro и поверхностного плазмонного резонанса.
Выяснилось, что рецепторы Ad5 и ChAdOx1 прочно связываются с CAR (что говорит о консервативности аденовирусов обезьян и человека), но не с CD46. И самое главное: как ChAdOx1, Ad5 и Ad26 связываются с PF4 с аффинностями 661, 789 и 301 нМ соответственно. Вакцинная форма AZD1222 также имеет сродство к PF4, с аффинностью 514 нМ. Специфичность комплексообразования подтверждали связыванием антител против PF4 с ChAdOx1/PF4 на чипе.
Авторы продемонстрировали, что поверхность ChAdOx1 в основном электроотрицательна и это позволяет ему притягивать положительно заряженные молекулы, такие как PF4. Размер и форма PF4 подходит для связывания с гексонами — шестиугольниками, из которых собрана частица аденовируса ChAdOx1. Связывание происходит главным образом в пространстве между шестиугольниками. Интересно, что образование комплекса ChAdOx1/PF4 ингибируется гепарином.
 ChAdOx1 "притягивает" PF4. Credit: Chun Kit Chan, Arizona State University
ChAdOx1 "притягивает" PF4. Credit: Chun Kit Chan, Arizona State University
Таким образом, иммуногенный комплекс, вызывающий ВИТТ, — это, скорее всего, комплекс PF4 с самим ChAdOx1, а не с ДНК или какими-либо белками клеточной линии, остающимися в вакцине после производства. Аналогичные комплексы образует PF4 с Ad5 и Ad26.
Подчеркиваем: речь идет о результатах, полученных in vitro. Доказано, что существуют такие взаимодействия молекул, но пока не доказано, что именно они становятся причиной крайне редких осложнений после иммунизации аденовирусными вакцинами. Поэтому дальнейшее следует расценивать как гипотезу.
По предположению авторов статьи, небольшие количества ChAdOx1 попадают в кровь через незначительные повреждения капилляров, вызванные внутримышечной инъекцией. В результате могут образоваться комплексы ChAdOx1/PF4 и самостоятельно либо в сочетании с тромбоцитами, и моноциты перенесут их в лимфатическую систему. Или же PF4, высвобождаемый в месте инъекции, может образовывать комплекс с вектором и проникать непосредственно в лимфатическую систему. Эти комплексы вирус/PF4 могут стимулировать существовавшие ранее В-клетки памяти против PF4 к дифференцировке в плазматические клетки, секретирующие антитела против PF4, что обычно занимает от 4 до 8 дней. Примечательно, что TTS гораздо реже наблюдается после второй дозы ChAdOx1, что позволяет предположить, что антитела против PF4 присутствуют очень недолго.
Авторы статьи обсудили и другую версию. Рецептор CAR, преимущественно экспрессирующийся в эпителиальных тканях, участвует в адгезии клеток; он присутствует также на поверхности агрегирующих тромбоцитов. Можно предположить, что сродство ChAdOx1 к CAR способствует агрегации, однако агрегаты аденовируса и тромбоцитов быстро доставляются в печень, где утилизируются. Поэтому авторы считают наиболее вероятным механизмом взаимодействие аденовируса с PF4.
Источник
Alexander Baker et al. ChAdOx1 interacts with CAR and PF4 with implications for thrombosis with thrombocytopenia syndrome // Science Advances. 2021. Vol. 7, Issue 49. DOI: 10.1126/sciadv.abl8213


 Меню
Меню





 Все темы
Все темы




 0
0








