При пигментном ретините отмирание колбочек можно предотвратить переключением их метаболизма
Ученые из США разработали новый подход к генной терапии пигментного ретинита. Отмирание колбочек сетчатки при этом заболевании происходит из-за недостатка глюкозы. Исследователи доставляли в колбочки мышиной модели ген Txnip, который усиливает катаболизм лактата. Это способствовало выживанию колбочек у мышей.
Пигментный ретинит — наследственное дегенеративное заболевание глаз, от которого страдают более 20 миллионов человек по всему миру. Оно прогрессирует медленно, сначала ведет к потере ночного зрения из-за генетического поражения палочек, потом — дневного из-за отмирания колбочек. Существует теория, что смерть колбочек связана с недостатком питательных веществ, в основном глюкозы.
Были разработаны несколько видов генной терапии пигментного ретинита, но обычно они помогают только небольшому числу семей с определенными мутациями. Ученые из Гарварда (США) разработали генную терапию, которая может предотвратить гибель колбочек независимо от вида мутации.
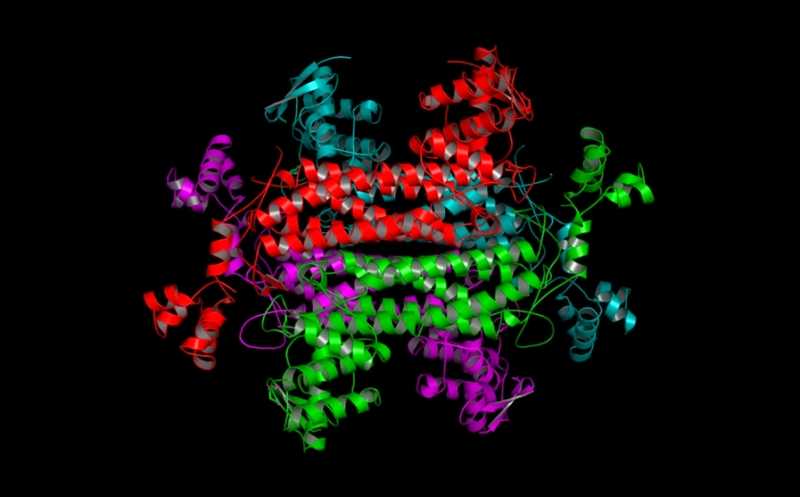
Исследователи использовали аденоассоциированные вирусные векторы для испытания эффективности 20 генов и их сочетаний на мышиных моделях. Большинство векторов несло гены, которые улучшали утилизацию глюкозы, под промотором, специфическим для колбочек. Первоначальный скрининг провели на мышах с неактивным геном Pde6b, что вызывает пигментный ретинит. Лучший результат в предотвращении отмирания колбочек показал вектор с геном Txnip, который кодирует белок семейства альфа-аррестина. Txnip способствует использованию питательных веществ, которые не являются глюкозой. Эффективность гена подтвердили на мышах с миссенс-мутацией в гене Pde6b и Rho-/--мышах с отсутствием родопсина.
У гена Txnip существует несколько аллелей, их изучение показало, что терапевтическое действие гена связано с наличием сайта S308. Txnip усиливает катаболизм лактата, кетоновых тел и липидов. Ученые показали, что оверэкспрессия Txnip препятствует смерти колбочек из-за дефицита глюкозы, переключая их метаболизм на использование лактата, но не кетоновых тел или липидов. Для этого необходима активность гена Ldhb, который превращает лактат в пируват.
Предложенный механизм подтверждает и тот факт, что Txnip увеличивал соотношение АТФ к АДФ в колбочках с неактивным Pde6b при их культивации ex vivo на лактате. Это не единственное свидетельство улучшения работы митохондрий. При оверэкспрессии Txnip у мышей с неактивными Pde6b и Rho экспрессия семи генов в колбочках повысилась, а 17 — снизилась. Среди генов, экспрессия которых возросла, три принадлежали к митохондриальным генам электронного транспорта. Сами митохондрии при этом увеличились в размерах, а их мембранный потенциал возрос.
Кроме того, экспрессия Txnip повышала активность натрий-калиевого насоса и экспрессию опсина в колбочках с неактивным Pde6b, культивируемых на лактате. Активация ферментов гликолиза, наоборот, ускоряла отмирание колбочек.
Ученые отметили, что экспрессия Nrf2, гена с антиоксидативной и противовоспалительной активностью, совместно с Txnip.C247S, увеличивала эффективность терапии.
«Нашим следующим шагом будет тестирование безопасности Txnip на других животных, кроме мышей, прежде чем перейти к клиническим испытаниям на людях. Если безопасность Txnip для людей подтвердится, то мы надеемся увидеть, как он станет эффективным подходом для лечения пигментного ретинита и других форм прогрессирующей потери зрения, таких как возрастная макулярная дегенерация», — объяснила Констанс Цепко, руководитель работы и профессор Гарвардской медицинской школы.
Источник
Xue Y., et al. // AAV-Txnip prolongs cone survival and vision in mouse models of retinitis pigmentosa // eLife (2021), 10:e66240, published April 13, 2021, DOI: 10.7554/eLife.66240
Цитата по пресс-релизу








 Меню
Меню





 Все темы
Все темы



 0
0