Георгий Георгиев: «Я всегда хотел сделать что-то крупное»
Академик Георгий Павлович Георгиев — возможно, самый авторитетный из ныне живущих молекулярных биологов. На него ссылаются все наши собеседники, его труды и сегодня в первых строках цитируемости. В 91 год Георгий Павлович сохраняет ясный ум и отменную память. А еще у него двое детей, и оба тоже молекулярные биологи, и тоже академики.

Родители
У меня довольно сложное этническое и социальное происхождение. Мой отец, Павел Константинович Георгиев — из простой крестьянской семьи в Бессарабии, на три четверти болгарин, на четверть турок. Он родился в 1875 году в селе под Комратом. После окончания гимназии в городе Комрате приехал в Петербург, поступил в Горный институт, стал инженером-изобретателем. После поражения России в Японской войне начал работать по созданию вооружений, чтобы поднять обороноспособность России. Он был очень талантлив и сделал много важных изобретений, за которые ему щедро платили. В результате незадолго до революции он приобрел собственный завод. Но после революции сразу стал нищим. Поскольку страна остро нуждалась в специалистах, его вскоре привлекли к работе по вооружениям. Он опять сделал ряд существенных изобретений и жил вполне хорошо в Ленинграде. Ему очень помогал Киров, хотя папа никогда не поддерживал Советскую власть. В 1937 году он был арестован «за вредительство и антисоветскую агитацию». Получил 10 лет тюремного заключения — работы на «шарашке».
Мама Анастасия Павловна Георгиева была из старой дворянской семьи Воронцовых- Вельяминовых, на три четверти русская и на четверть немка. Она встретила отца в начале 1920-х, полюбила, вышла замуж. Прожили очень счастливо 12 лет, а затем произошла эта катастрофа. Мама очень много хлопотала об отце, писала заявления в разные инстанции, а в 1939-м ее тоже забрали, обвинив в организации покушения на Молотова. Она получила 8 лет лагерей. Когда отца арестовали, мне было 4 года, когда маму — 6 лет. Я остался с бабушкой и дедушкой, мамиными родителями, жившими в Москве.
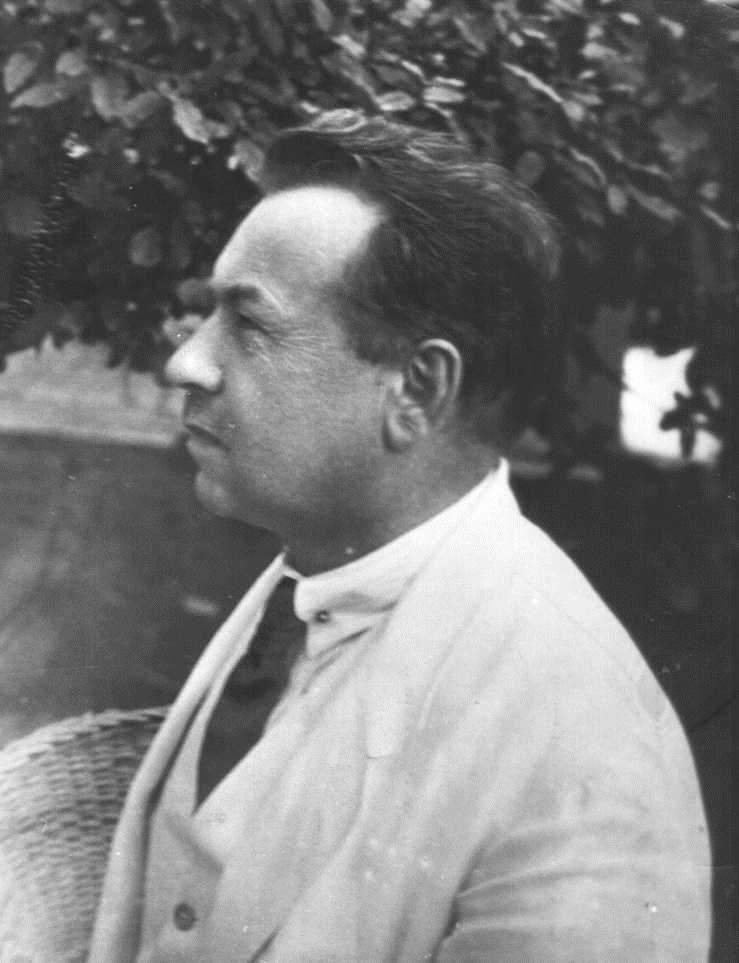 Павел Константинович Георгиев (1875–1941)
Павел Константинович Георгиев (1875–1941)
 Анастасия Павловна Георгиева (Воронцова-Вельяминова) (1902–1994). Портрет А.Р. Эберлинга (около 1929 г.).
Анастасия Павловна Георгиева (Воронцова-Вельяминова) (1902–1994). Портрет А.Р. Эберлинга (около 1929 г.).
 Родители. На даче под Ленинградом.
Родители. На даче под Ленинградом.
Отец скончался в 1941-м в Ленинграде. Мама в 1947-м вышла из лагеря, но должна была жить не ближе 100 км от Москвы (Александров, потом Рыбинск). В 1949-м ее снова арестовали. Она перестала отвечать на письма. Я поехал на ее розыски и нашел в Ярославской тюрьме. Нового дела не заводили, а просто сослали на «вечное поселение» в Сибирь. Она жила в 110 км от Красноярска в поселке Большая Мурта. Я каждый год проводил с ней лето. К счастью, в 1953-м Сталин умер, и ее, как и отца, реабилитировали.
В 1954-м году я привез ее в Москву. Она прожила с нами еще 40 лет — до 92 лет, дождавшись появления не только внуков, но и правнуков.
 А.П. в ссылке
А.П. в ссылке
 После ссылки
После ссылки
 В кругу семьи (1973 г.)
В кругу семьи (1973 г.)
«Непрестижный» медицинский институт
Мой выбор будущей профессии был довольно случайным. С детства я был очень честолюбив, хотел реализоваться в чем-то значительном. Сначала были нереальные идеи — я хотел пойти работать в КГБ, продвинуться там и свергнуть Сталина. Конечно, скоро понял, что это чепуха. Лет в 12 решил, что единственный путь для самоутверждения — это наука. Однако я терпеть не мог школу, учился достаточно плохо, и биология меня абсолютно не интересовала. Я немножко интересовался астрономией, потом понял, когда стал подрастать, что ни в физику, ни в астрономию меня как сына «врагов народа» не примут. Поэтому решил, что физические науки — дело дохлое, и выбрал биологию. При этом понятия о биологии не имел, годовая оценка по ботанике была 3.
В восьмом классе решил, что для успешного поступления в вуз важно иметь медаль, и стал избирательно заниматься предметами, шедшими в аттестат, получать по ним пятерки. Мне это было несложно. В 10-м уже пришлось вкалывать по всем предметам. Получил золотую медаль, сдав все экзамены на «пятерки». Первый раз в жизни получил «пять» за сочинение, также единственный раз в жизни воздав хвалу Сталину. Темой сочинения были его слова «В нашей стране труд стал делом чести, славы, доблести и геройства». У меня были шпаргалки с цитатами на все случаи жизни, так что все прошло гладко.
Сдал документы на биофак МГУ, прошел собеседование. На нем спрашивали только о родителях. Последовал отказ «за отсутствием мест». Подал документы в 1-й Мединститут, и после собеседования был туда зачислен. В него брали всех «нехороших людей»: детей «врагов народа» и евреев, против которых тогда велась кампания, борьба с космополитами. В стране не хватало врачей, но эта профессия была низко оплачиваемой и среди молодежи крайне непрестижной.
 В Мединституте
В Мединституте
В институте я сразу стал искать, по какой специальности заниматься наукой. Посещал разные кружки, но всюду мне не нравилась тематика исследований. Два года прошло в безуспешных поисках. Наконец, на 3-м курсе прочитал как-то две обзорные статьи Б.В. Кедровского о нуклеиновых кислотах. Мне сразу показалось, что именно в этой области и следует работать.
Начал поиски кафедры, где можно работать по нуклеиновым кислотам. В институте у нас ничего подходящего не было. Я в это время организовал среди студентов Онкологическую секцию. Она проводила в Мединституте доклады ведущих ученых- онкологов, доклады членов секции, а также экскурсии членов секции в научно-исследовательские институты.
Во время одной такой экскурсии в Онкологический институт имени Герцена нас принимал Илья Борисович Збарский (сын Б.И. Збарского, который занимался бальзамированием Ленина и в это время был под арестом). Исследования Ильи Борисовича по белковым фракциям ядер нормальных и опухолевых клеток мне понравились. После экскурсии я к нему зашел и попросил разрешения работать в его лаборатории по изучению нуклеиновых кислот в составе фракций. Он с удовольствием согласился. Я там и проработал у него по вечерам после занятий пару лет, вплоть до окончания института.
 Илья Борисович Збарский (1913–2007)
Илья Борисович Збарский (1913–2007)
Онкология и нуклеиновые кислоты
Почему меня привлекла именно онкологическая тематика? Видимо, в силу того, что было желание совершить что-то крупное. Решил, что буду стремиться найти способ лечения рака. Когда рак и нуклеиновые кислоты соединились, я пошел в этом направлении. Впрочем, мои основные исследования были долгое время далеки от онкологической тематики, и только много позднее я к ней подошел.
Когда я кончал институт, Збарский получил место заведующего лабораторией в Институте морфологии животных имени Северцова АН СССР (в той его части, из который позднее произошел Институт биологии развития им. Н.К. Кольцова). Там и началась моя научная деятельность. Вначале я был единственным сотрудником в лаборатории, и на мне лежала вся работа по организации ее на пустом месте, вплоть до перетаскивания химических столов. В свободное время вел опыты по придуманным мною темам, делал много ошибок, но в результате научился полной самостоятельности в принятии решений.
Моя кандидатская диссертация была посвящена изучению фракций клеточного ядра, описанных Збарским. По этой теме начал работать еще в институте имени Герцена, то есть она явилась продолжением студенческой работы. Удалось связать эти фракции с определенными структурами клеточного ядра.
После защиты кандидатской диссертации Илья Борисович предоставил мне полную научную независимость. Я стал заниматься исследованием РНК клеточного ядра. В 1960 году был известен один тип высокополимерной РНК — рибосомная РНК. Ничего не было известно про информационную РНК, которая участвует в переносе информации от ДНК к белку. Основными характеристиками РНК и ДНК были в то время молекулярный вес и нуклеотидный состав.
Нуклеиновые кислоты состоят из четырех нуклеотидов, в состав которых входит аденин (А), гуанин (Г), цитозин (Ц) и либо тимин (Т) в ДНК, либо урацил (У) в РНК. Отношение Г+Ц/А+Т (в ДНК) или Г+Ц/А+У (в РНК) является важной характеристикой нуклеиновой кислоты. Это отношение для ДНК мыши равно 0,7, а для рибосомной РНК — 1,6. Таким образом, по нуклеотидному составу известная тогда РНК резко отличались от ДНК. В переносе информации она участвовать не могла. Высказывались лишь предположения о существовании информационной РНК.
Исследуя РНК клеточных ядер, мы с моей первой сотрудницей Вероникой Мантьевой обнаружили в 1961 году в ядрах фракцию РНК, по составу соответствующую ДНК, то есть информационную РНК в клетках животных. Вначале мы разработали метод получения чистой ядерной РНК. Она содержала в своем составе компоненты, по молекулярному весу напоминающие рибосомную РНК. Однако отношение Г+Ц/А+У составляло около 1,2. Возникло явное противоречие между этими двумя результатами, и я предположил, что ядерная РНК содержит два типа РНК. Мы разработали новые методы фракционирования клеточных ядер, выделили две фракции РНК, одну с отношением Г+Ц/А+У=1,6, другую с отношением – 0,7, то есть информационную РНК.
В том же году, за два-три месяца до нас информационную РНК детектировали на Западе у бактерий, дав ей название мРНК (mRNA — messenger RNA), о чем у нас стало известно лишь позднее из-за задержек в получении западных журналов.
Поскольку нам удалось впервые изолировать чистую информационную РНК, мы стали активно изучать ее свойства (совместно с Ольгой Самариной и Михаилом Леманом). Оказалось, что у бактерий и у высших организмов образование мРНК происходит по-разному. У бактерий, не имеющих ядра, сразу синтезируется зрелая мРНК. У животных в ядре сначала образуется ее гигантский предшественник, пре-мРНК. Затем в ядре происходит ее частичный распад и превращение в более короткую зрелую мРНК. Последняя переносится далее в цитоплазму, где и участвует в синтезе белка, выступая в роли матрицы.
Удалось также разработать метод выявления мРНК в цитоплазме и показать, что она имеет значительно меньшие размеры, чем пре-мРНК. Все эти результаты мы опубликовали в журнале Nature. Статья стала одной из классических статей по числу цитирований. По работам, связанным с исследованием ядерных РНК, защитил в конце 1962 года докторскую диссертацию. Причины синтеза гигантской пре-мРНК были выяснены много позднее другими авторами.
ИМБ. РНП-частицы
Между тем в 1962-м меня стали приглашать в разные институты на заведывание лабораторией. Было шесть таких приглашений. Я хотел иметь собственную лабораторию, но все предложения меня не до конца устраивали. Кроме того, прошел слух, что мной интересовался В.А. Энгельгардт (далее — ВА), а меня это сразу насторожило. Вдруг он меня пригласит в свой институт? Это был тогда лучший институт, а ВА — великий ученый, несомненно, номер один в своем поколении, автор двух крупнейших открытий. Но он долго со мной не контактировал.
Когда в начале 1963-го я уже подумал, не принять ли одно из предложений, меня вызвал Энгельгардт и предложил возглавить одну из лабораторий в его институте. Я, не раздумывая, согласился. Так я попал в Институт физико-химической и радиационной биологии АН СССР, позднее Институт молекулярной биологии АН СССР и, наконец, Институт молекулярной биологии им. В.А. Энгельгардта РАН (далее — ИМБ).
 Владимир Александрович Энгельгардт (1894–1984)
Владимир Александрович Энгельгардт (1894–1984)

В ИМБ я проработал более 20 лет. Это были наиболее плодотворные годы моей научной жизни. Мы завершили работы по характеристике ядерных РНК. Далее мы с Ольгой Самариной установили, что в ядрах животных клеток вся пре-мРНК и мРНК входят в состав специфических рибонуклеопротеидных (РНП) частиц.
Вначале из ядер клеток был получен экстракт, содержащий гомогенные глобулярные частицы диаметром в 20 нм, которые содержали всю ядерную пре-мРНК. Однако молекулярный вес выделенной из них РНК был много ниже, чем ранее полученный для пре-мРНК. Это противоречие можно было объяснить деградацией РНК в ходе выделения РНП частиц. Чтобы ее подавить, выделили белок, ингибирующий действие фермента рибонуклеазы, которая расщепляет РНК, и стали добавлять его во все растворы при получении ядерных экстрактов.
В результате вместо гомогенных частиц размером в 20 нм получили цепочки таких частиц разной длины, вплоть до десятков частиц на одной цепочке. При обработке малыми дозами рибонуклеазы они распадались на моночастицы. Таким образом, пре-мРНК длиной в тысячи нуклеотидов связывается в ядре с серией глобулярных белковых частиц.
Далее мы установили, что всю РНК можно удалить из РНП частиц, не меняя при этом их размеров. Из полученных белковых частиц и свободной РНК можно было реконструировать РНП частицы, не отличимые от исходных.
Из всех этих данных следовало, что пре-мРНК длиной в тысячи нуклеотидов располагается на поверхности серии одинаковых глобулярных мультибелковых частиц, соединенных короткими мостиками РНК. На одну белковую частицу намотана РНК длиной в 700 нуклеотидов. Это был ранее не известный тип нуклеопротеидов. Такая структура обеспечивает сокращение линейных размеров РНК. В то же время РНК, находясь на поверхности частиц, становится доступной для взаимодействия с различными белковыми факторами, контролирующими ее превращение из пре-мРНК в мРНК и транспорт к ядерной мембране. При переносе в цитоплазму мРНК выходит из состава частиц и связывается с другими белками. Работа была удостоена Ленинской премии вместе с работой А.С. Спирина по открытию информосом — мРНП частиц другого типа в цитоплазме.
Мобильные элементы
Следующий важный этап наших исследований — это открытие мобильных генетических элементов в геноме животных и выяснение природы рассеянных по геному повторяющихся последовательностей ДНК. Мы пытались выяснить общие принципы структуры генов животных и проверить нашу гипотезу. Было известно, что в геноме животных имеется много одинаковых по структуре и рассеянных по геному отрезков ДНК длиной от сотен до тысяч нуклеотидных пар. Они повторяются в геноме от десятков до тысяч раз. Их природа оставалась непонятной. Считалось, что они не являются генами. Я предположил, что рассеянные по геному «повторы» представляют собою регуляторные элементы гена и лежат перед участками, кодирующими мРНК.
Для проверки гипотезы провели клонирование ДНК дрозофилы. Отобрали те клоны, ДНК которых гибридизовалась с мРНК и с повторами из генома. ДНК из таких клонов стали дробить на субфрагменты, которые гибридизовались бы или с мРНК (гены), или с повторами генома. Однако все субфрагменты полученных клонов гибридизовались и с мРНК, и с повторами, то есть мы имели дело с повторяющимися генами. Это противоречило проверяемой гипотезе, но было весьма интересно, так как говорило о природе рассеянных по геному повторов, а именно, что они кодируют мРНК, то есть являются истинными генами. Откуда могли взяться такие гены и что они кодируют, было непонятно.
Далее определили расположение генов нового типа на хромосомах. Они действительно были рассеяны по всем хромосомам. Неожиданно оказалось, что расположение этих генов в хромосомах не является фиксированным. Оно варьирует у разных особей дрозофилы.
Таким образом, рассеянные по геному повторы являются не обычными генами, а мобильными генетическими элементами (МГЭ). В результате была выяснена природа рассеянных по геному повторов.
Самым неожиданным было, что в геноме животных присутствует огромное число МГЭ. На них приходится около 20% всего генома. Работа была опубликована в журнале Science в 1977 году. В ней участвовали Юрий Ильин и Николай Чуриков из моей лаборатории, а также Владимир Гвоздев и Евгений Ананьев из Института молекулярной генетики.
Эгоистическая, но полезная ДНК
Впервые одиночные «прыгающие гены» были открыты у кукурузы американкой Барбарой Макклинток еще в 1940 году чисто генетическими методами. В то время это исключало возможность их дальнейшего изучения, и работа была встречена с недоверием. Только после открытия МГЭ животных и бактерий и проведения молекулярных исследований работа Макклинток была удостоена Нобелевской премии.
Началось активное изучение МГЭ дрозофилы и мыши. Мы изолировали и определили структуру десятка разных индивидуальных МГЭ. Были выделены два основных типа МГЭ. Один тип — протяженные МГЭ (тысячи нуклеотидов) — по структуре похож на ретровирусы. Это активные МГЭ. Они часто содержат гены, кодирующие белки, необходимые для их размножения и внедрения в новые места генома. Другой тип — короткие МГЭ (200–300 нуклеотидов). Это пассивные МГЭ, которые вообще не кодируют белки, но содержат последовательности ДНК, позволяющие им взаимодействовать с белками, продуцируемыми активными МГЭ. Так вместе с Алексеем Рысковым и Дмитрием Крамеровым мы впервые обнаружили короткие МГЭ, последовательности В1 и В2, повторяющиеся в геноме мыши сотни тысяч раз. Работы по МГЭ были удостоены Государственной премии СССР (коллектив из 10 человек).
Какова роль столь многочисленных МГЭ? Доминирует мнение, что они представляют собою «эгоистическую ДНК», которая не выполняет каких-либо функций, но размножается в геноме благодаря наличию в составе нужных генов и необходимых последовательностей. Весьма вероятно, что возникновение многих МГЭ явилось результатом инфекции ретровирусами, которые после ряда мутаций превратились в МГЭ. Действительно, Ильин уже в своей собственной лаборатории раскрыл все последовательные этапы размножения МГЭ данного типа и показал, что они идентичны этапам размножения ретровирусов. Клетки выработали механизмы для удаления из генома МГЭ, и установилось равновесие между их размножением и удалением из генома.
Тем не менее наличие в геноме МГЭ играет, вероятно, важную роль. Прежде всего, их перемещения могут стимулировать мутагенез и являться важным фактором изменчивости и эволюции. Действительно, очень многие мутации, иногда полезные для организма, возникают в результате внедрения МГЭ.
Хроматин
Кроме этих работ, в разное время был выполнен ряд важных исследований по хроматину, т.е. по материалу хромосом в интерфазных ядрах. Мы с Юрием Ченцовым обнаружили скелетные структуры хромосом в ядрах с помощью электронной микроскопии изолированных ядер после их экстракции разными растворителями. Далее с Сергеем Разиным и Евгением Луканидиным определили, в каких местах ДНК прикрепляется к этому скелету. Это были участки, с которых начинается репликация ДНК.
Удалось также выяснить ключевые отличия хроматина в активных зонах, где идет синтез РНК, и репрессированного хроматина. В активном хроматине отсутствует гистон Н1 (работа выполнена совместно с Юрием Козловым и Ларисой Ананьевой), и в нем возникают так называемые торсионные напряжения (совместно с Андреем Лучником).
 В.А. Энгельгардт c Г.П. Георгиевым
В.А. Энгельгардт c Г.П. Георгиевым
 Визит Джима Уотсона в лабораторию Г.П. Георгиева (снимок у входа в ИМБ)
Визит Джима Уотсона в лабораторию Г.П. Георгиева (снимок у входа в ИМБ)
Таким образом, научная работа нашей лаборатории в ИМБ развивалась вполне успешно. Наши работы пользовались мировым признанием. В лабораторию приезжали на стажировку ученые из многих стран мира: США, Канады, Германии, Англии, Японии и других. В то же время внеинститутская ситуация стала непростой.
Виртуальный институт
Начиная с 1974 года у меня были очень сложные отношения с Ю.А. Овчинниковым. Будучи кандидатом в члены ЦК КПСС и вице-президентом Академии, он полностью контролировал биологию в СССР. Из-за плохого отношения к ВА, а затем и ко мне он блокировал мой карьерный рост, в частности, не пропуская в академики. С другой стороны, учитывая мою популярность на Западе, Овчинников выделял мне достаточно валюты, чтобы я мог успешно работать, покупая нужные реактивы. Более того, когда в Москве происходил организованный им конгресс FEBS, то пленарным докладчиком от СССР он назначил меня. Все же в 1987 году, вопреки его воле, меня избрали в академики, что резко усилило мои позиции. В 1988 году Овчинников скончался, выделив мне за несколько дней до смерти крупную сумму валюты, обеспечившую мне работу на несколько лет вперед. Так что в целом я должен быть ему благодарен.
Ранее, еще в 1984 году, скончался ВА, после чего обстановка в ИМБ осложнилась, особенно после 1987 года. Поэтому я стал искать варианты, как улучшить условия для научной работы.
В 1989 году я предложил создать виртуальный институт из лучших лабораторий, в области молекулярной биологии. Физически они оставались бы там, где были, но при этом получали бы особое финансирование, и в них проводилась бы активная подготовка молодых научных кадров.
Эта идея ряду начальников очень понравилось. Меня активно поддержал вице-президент Рэм Викторович Петров, а затем и президент Академии Гурий Иванович Марчук. Они начали переговоры с директорами, чьи лаборатории вошли бы в эту структуру.
Те страшно перепугались, решив, что это ограничит их власть в институте. Узнав, что инициатива идет от меня, они начали просить, чтобы мне дали свой институт. Так начались разговоры о создании нового института уже «под меня». Когда об этом узнал Марчук, он поддержал идею. Хотя это нравилось мне меньше, чем создание виртуального института, и требовало больше скучной административной работы, но выбора не было.
Рождение ИБГ
Был подписан приказ о создании Института биологии гена (ИБГ). На самом деле, я предложил название «Институт молекулярной биологии гена» но Президиум одно слово пропустил. Институт был пока только на бумаге. В частности, у него не было здания.
Начался тяжелый этап — создание института. Я сохранил лабораторию с ИМБ, но не мог уделять ей достаточно времени.
В 1984 году Институт биоорганической химии (ИБХ) переехал из здания на улице Вавилова в новое роскошное здание, отдав свое помещение ИМБ. Однако у него оставалось еще одно более скромное здание, которое Институт стал сдавать в аренду разным фирмам. Я попытался получить это здание для нового института, но дирекция ИБХ, конечно, отказалась. Попытка добиться этого через Президиум РАН успеха не имела, поскольку никто не хотел ссориться с директором ИБХ.
Решил привлечь к делу академика Александра Спирина, члена президиума РАН, известного своей резкостью. Мы с ним были не друзьями, а жесткими конкурентами, но при этом относились друг к другу с уважением. Я ему рассказал о сложившейся ситуации, и он сразу обещал помочь. На следующее заседание «наверху» пригласили Спирина. Он первым взял слово: «Просто аморально для ИБХ держаться за это здание, получив такой дворец!» Все вздохнули с облегчением оттого, что кто-то взял на себя неприятное предложение, и проблема решилась за несколько минут — здание передали на наш баланс. Так решился вопрос о здании для института. Было еще много проблем, но постепенно мы их все решили.
Большую роль в этом сыграл мой заместитель Николай Гнучев, блестящий администратор. В ИБГ мои исследования наконец сосредоточились в основном на проблемах молекулярной онкологии.
В 90-х годах пришла в голову оригинальная идея — организовать в Калининградской области Российско-Германский институт молекулярной биологии. Мы обеспечивали бы строительство института и жилья, а немцы — оборудование и снабжение. Работать должны были на равных ученые из Германии и России. Поговорил с нашими начальниками — отношение весьма благоприятное, очень хочется дружить с ФРГ. Поговорил с ведущими немецкими учеными — тоже. У них еще и ностальгия по Кенигсбергу. Их начальство тоже отнеслось позитивно. Поехали с Гнучевым в Калининград. Там местное начальство пришло в восторг. Нам дали машину и повезли показывать разные красивые места для строительства. Мы с Гнучевым выбрали площадку под Светлогорском. Началась подготовка соглашения. Все было отлично, но тут вмешалась Польша, болезненно относящаяся к любому интересу Германии в Восточной Пруссии. Она надавила на Германию, и чиновники ФРГ испугались реализовывать идею.
Tag7 против опухолевых клеток
На первом этапе были продолжены работы, начатые еще в ИМБ, где Евгений Луканидин в моей лаборатории открыл ген mts1, белковый продукт которого Mts1 оказался мощным стимулятором метастазирования опухолей. Луканидин заведовал одной из лабораторий ИБГ. К сожалению, в 1991 году он эмигрировал в Данию, куда его пригласили заведующим лабораторией именно для изучения белка Mts1. Мы с ним на первом этапе широко сотрудничали, имея хороший совместный европейский грант.
Так, например, было показано, что, если ввести в геном неметастазирующих опухолевых клеток генетическую конструкцию, обеспечивающую синтез Mts1, то такие клетки приобретают способность давать метастазы. Были выяснены механизмы стимуляции метастазирования белком Mts1. Позднее вообще оказалось, что уровень экспрессии гена mts1 является одним из лучших маркеров метастатического потенциала опухоли.
Нельзя ли использовать инактивацию Mts1, например, с помощью антител для борьбы с метастазированием опухолей? Перспективы здесь имеются. Эту работу по нашему договору вел Луканидин в Дании. В опытах на животных был получен позитивный эффект. До клинических испытаний дело не дошло. Не исключено, что такая работа может быть организована в нашей стране.
После завершения совместных работ с Луканидиным мы с Андреем Кабишевым, Сергеем Киселевым и Сергеем Лариным открыли новый ген, названный tag7, белковый продукт которого Tag7 обладал защитными противоопухолевыми свойствами. Мышам перевивали исходные опухолевые клетки либо клетки, модифицированные генетической конструкцией, обеспечивающей синтез белка Tag7. В контроле опухоль быстро росла и убивала мышь. Опухоль, продуцирующая белок Tag7, росла гораздо медленнее и затем вообще рассасывалась. Более того, если добавлять клетки, синтезирующие Tag7, к исходным опухолевым клеткам, во многих случаях тоже происходило уничтожение опухоли.
Лекарство, сделанное в лаборатории: «лечить нельзя запретить»
Начались исследования механизмов действия этого белка. Основным его эффектом является мобилизация к опухоли, синтезирующей Tag7, защитных Т лимфоцитов и NK клеток, которые атакуют и уничтожают клетки опухоли.
В начале двухтысячных, когда был благоприятный для науки период, мы провели доклинические испытания у себя в лаборатории, а потом начались клинические испытания в Институте онкологии имени Петрова в Питере.
Основные этапы получения вакцины состояли в следующем: (1) из операционного материала брали опухолевые клетки; (2) получали из них культуру клеток; (3) вводили в их геном генетическую конструкцию, обеспечивающую синтез белка Tag7; (4) нарабатывали модифицированные клетки в значительных количествах и (5) замораживали их. Эти клетки и являлись вакциной, вводившейся подкожно тому же пациенту, от которого были исходно получены эти опухолевые клетки. Вакцину вводили многократно с интервалами в 2 недели. Испытания велись на безнадежных больных с меланомой или раком почек.
Большей части больных вакцина не помогала, они умирали через год-два. Однако 25% пациентов выжило по крайней мере до пяти лет. А дальше клиницисты наблюдали за 15% больных (12 человек), которые были практически здоровы. Они постепенно исчезали из поля зрения, но на этот момент у них никаких признаков прогрессии опухолей не было. Результаты клинических испытаний были признаны перспективными, и предложено их продолжение и поиск улучшения протокола терапии.
А в 2007 году приняли американские правила, которые сразу почти полностью блокировали внедрение в практику достижений биомедицины. Эти правила требовали, чтобы испытания и производство лечебных препаратов проводились в специальных сертифицированных учреждениях. Хотя питерский институт и был сертифицирован для клинических испытаний, но доклинические испытания (опыты на животных) велись в нашей лаборатории, а производство вакцины проводилось либо тоже у нас, либо в Институте онкологии имени Петрова, кстати, задолго до принятия новых правил. Поэтому в 2007 году лечение пациентов было запрещено.
Тем не менее наблюдения за пролеченными пациентами продолжалось. В 2020 году, через 15 лет после проведения лечения, была опубликована статья, суммирующая полученные результаты. Однако Минздрав отказался засчитывать проведенную вторую фазу клинических испытаний и предложил снова проводить производство и доклинические испытания в сертифицированном учреждении. Интересно, что в России для производства такого рода препаратов тогда еще и не существовало сертифицированной организации. (Механизмы, регулирующие производство персонализированных биомедицинских клеточных продуктов, в нашей стране начинают запускаться только сейчас — после появления CAR T-терапии и других подобных технологий. — PCR.NEWS.)
Организация науки: Новые группы и Государственный фонд внедрения
После 1987 года, когда меня избрали академиком, я стал активно заниматься научно-организационными проблемами. В 1988-89 г. мне удалось организовать программу «Приоритетные направления генетики», поддерживающую на хорошем материальном уровне исследования в лучших генетических и молекулярно-генетических лабораториях страны. На программе стояла виза М.С. Горбачева, который вообще стремился поддерживать науку в СССР. При Ельцине начался развал науки, и финансирование программы скоро прекратилось.
В 2002 году мне удалось организовать в рамках программ Президиума РАН экспериментальную программу «Молекулярная и клеточная биология». Ее основные принципами были: (1) выдача крупных грантов на 5 лет, (2) отбор лучших лабораторий на основании объективных показателей, (3) поддержка специальными грантами независимых Новых групп под руководством сравнительно молодых ученых, которые выполнили сильные работы, но не имели еще собственного коллектива. Конкурс был прозрачным, все показатели вывешивались в Интернете, и коррупция была полностью исключена. Можно было обжаловать решение экспертной комиссии в независимом контрольном совете.
Где-то к 2020 году наша программа была ликвидирована Минобрнауки вместе со всеми программами РАН, хотя она и считалась среди научной общественности лучшей конкурсной программой. Стоит отметить, что среди ученых, получивших грант программы, в дальнейшем стали академиками 21 человек, а членами-корреспондентами РАН 39. При этом 11 из них прошли путь от руководителя Новой группы, обычно кандидата наук до члена-корреспондента РАН. Мне приходил письма, где ставшие крупными учеными лица писали, что это произошло только благодаря нашей программе.
В 2020-х годах занимался проблемам внедрения достижений биомедицинских исследований в медицинскую практику, где все мои усилия превратились в борьбу с ветряными мельницами. Постепенно цены, которые требовали сертифицированные организации, росли, и получение средств для их оплаты разработчиками из РАН стало практически невозможным.
Основное предложение для решения проблемы внедрения состояло в освобождении разработчика от организации и поиска финансирования для производства и испытаний. Это должно было стать функцией нового Государственного фонда внедрения, «ГФВ-Биомедицина». Фонд должен был обеспечить производство и испытания разработок ученых, отобранных Советом фонда. За это фонд получал бы от разработчиков и института все права на дальнейшее их использование. В случае успешных испытаний и коммерциализации институт и разработчики получали заранее оговоренное вознаграждение. Доходы от внедрения успешных разработок были бы выше затрат, и через какое-то время фонд переходил бы на самофинансирование.
Идея почти всем, включая президентов РАН, нравилась, но протолкнуть ее через Минздрав из-за бюрократических препон не удалось. Между тем я знаю много академических лабораторий, где хорошие разработки намертво стоят, потому что разработчики сами не могут достать деньги для оплаты производства и испытаний в сертифицированных учреждениях.
Клеточная вакцина против рака
Наша группа в ИБГ стала искать способы повысить эффективность вакцины. Возникло две идеи. Одна из них была проверена в опытах на животных. Она состояла в комбинированном использовании двух факторов, привлекающих к опухоли защитные лимфоциты, — нашего Tag7 и известного фактора GM-CSF. Последний уже испытывался на Западе в качестве терапевтического агента, но без больших успехов. Мы провели опыты по терапии одной из самых злокачественных меланом мышей, В16. Вакцина из генетически модифицированных опухолевых клеток, которые продуцировали и Tag7, и GM-CSF, оказалась в разы более активной, чем испытанная ранее. Казалось бы, сейчас надо начинать проверку нового варианта вакцины, но опять — проблемы с финансированием производства и испытаний.
Проверка второй идеи стала возможной недавно в связи с появлением в продаже ряда препаратов. Сейчас на Западе разработан другой эффективный метод терапии, разрешенный к применению. Дело в том, что лимфоциты несут на своей поверхности рецептор PD1, с которым взаимодействует лиганд PDL1, синтезируемый целым рядом опухолей. В результате их взаимодействия лимфоцит перестает узнавать опухолевую клетку. Антитела против рецептора или против его лиганда подавляют это взаимодействие, и активность лимфоцита восстанавливается. Пятилетняя выживаемость пациентов с меланомой достигает 50%. Сейчас эти антитела получены и в России.
Существенно, что антитела и наша вакцина имеют разный и дополняющий друг друга механизм действия. Tag7 привлекает к опухоли защитные лимфоциты, а антитела препятствуют ускользанию опухолевых клеток от их атаки. Это и есть наша вторая идея усиления эффекта вакцины. Очень надеюсь, что комбинация двух методов терапии обеспечит полную победу над меланомой. Но предугадать конечный результат все равно невозможно.
Сможем ли мы победить рак, если все препятствия будут удалены? На этот вопрос ответить трудно. Прежде всего, есть много типов опухолей. Успешное лечение от одного из них не означает решение терапии всех других.
Благодарности
Я в своей научной жизни очень благодарен целому ряду людей. Один из них — Борис Васильевич Кедровский. Я ему крайне обязан тем, что его обзорные статьи открыли мне мир нуклеиновых кислот, определив направление моей будущей работы. Его судьба была трагической. Он впервые в мире показал значение РНК в синтезе белка еще в конце 1930-х годов, когда работал в институте, возглавляемом выдающимся ученым Н.К. Кольцовым. Борис Васильевич хотел публиковаться, но даже Кольцову результаты показались слишком революционными, и он не дал своего благословления. Рекомендовал доработать. Кедровский проработал еще пару лет, и Кольцов дал добро на публикацию. Это было начало 1941 года. Борис Васильевич послал статьи в немецкий журнал — Германия тогда была мировым научным центром. И тут грянула война. Даже если статьи и были опубликованы, их никто не заметил. Вся слава досталась Жану Браше (Бельгия) и Торбьерну Касперсону (Швеция), пришедшими к тем же выводам пять лет спустя. Так у него пролетело важнейшее достижение его жизни. Потом Борис Васильевич сильно заболел и сразу добровольно ушел на пенсию. Позднее мы с ним познакомились. Я часто его навещал, беседовали о науке и жизни, стали друзьями.
 Борис Васильевич Кедровский (1898–1970)
Борис Васильевич Кедровский (1898–1970)
Важнейшую роль в моей судьбе сыграл Илья Борисович Збарский, у которого я начал работать после Мединститута. Моя кандидатская диссертация явилась продолжением его исследований. Его решение предоставить мне после ее защиты полную свободу поиска (мне было тогда 26 лет) поистине уникально. Он также перестал подписывать мои статьи.
Много позднее наши лаборатории провели ряд совместных работ, результатом которых явились наши с ним совместные публикации в самых престижных журналах (Cell, EMBO J.).
Я, конечно, испытываю огромную благодарность к Владимиру Александровичу Энгельгардту, ВА. Рядом с ним прошло более 20 прекрасных лет моей научной жизни. ВА был замечательным человеком и великим ученым, сделавшим два основополагающих открытия. Он мог получить Нобелевскую премию, но в тот год, когда уже подходило положительное решение комитета, появилась заметка в Nature, что наших ученых не пускают за границу. Руководство обратились к ВА, чтобы он написал ответ на нее. При этом была угроза, что в случае отказа будут серьезные неприятности его детищу ИМБ. При написании заметки институту обещали разные блага. Ради института ВА написал ответ, что наши ученые получают так много приглашений, что просто не успевают ездить на все конференции. После публикации ответа в Nature о Нобелевской премии можно было забыть. Ради ИМБ ВА сознательно пожертвовал своими интересами.
Характерна для ВА история, как он вывез меня впервые на Запад. Хотя уже давно окончился сталинизм, но по инерции меня туда не пускали, несмотря на то, что я получал много приглашений не разные конгрессы и конференции с оплатой всех расходов. Когда я получил очередное приглашение, то показал его ВА, добавив, что нет смысла обращаться в Иностранный отел Академии. Однако ВА решил претворить это в жизнь. Послал в Лондон заявку на себя, и ему сразу пришло приглашение также с оплатой всех расходов. ВА обращается в Иностранный отдел с тем, что ему по возрасту требуется сопровождающее лицо, и он просит оформить его и меня. Нас оформляют, но в последний момент приходит информация, что решение ЦК есть только на него. ВА отвечает, что один ехать не может, и в результате будет международный скандал. Через час пришло решение ЦК и на меня.
Накануне отъезда оказалось, что есть только один билет на самолет. ВА говорит, что пусть едет один Георгиев, а он останется. Через час нашелся и второй билет. Полетели с ним в Англию. Он меня знакомил с Лондоном, с Кембриджем, которые прекрасно знал и любил. ВА был и на симпозиуме, все прошло прекрасно. После этого меня стали свободно выпускать на Запад, без ограничений. Хотя в партию я никогда не вступал, даже когда меня очень уговаривали, это мне уже не мешало.
Я, конечно, очень благодарен моим дорогим сотрудникам, без которых все мои работы не были бы выполнены. Я по ходу дела о них говорил. Особенно хотелось отметить Самарину, Мантьеву, Ильина, Чурикова, Луканидина и Рыскова. Они внесли и серьезный идейный вклад в нашу работу.
Научные планы
Какие у меня научные планы? Хотелось бы продолжить начатые работы по терапии онкологических заболеваний и по двум перспективным фундаментальным проектам, а главное, передать их в надежные руки.
В 2006 году я ушел с поста директора ИБГ по возрасту. Новым директором был избран мой ученик академик Юрий Ильин. Он проработал на этом посту пять лет, после чего тоже ушел с него по возрасту. Следующим директором стал академик Павел Георгиев.
В настоящее время работаю в Лаборатории молекулярной генетики внутриклеточного транспорта, возглавляемой Александром Соболевым, очень сильным ученым. В 90-х годах мы с ним участвовали в Онкологической программе, которую организовал мэр Москвы Ю.М. Лужков. Однажды Соболев попросил меня взять его в наш институт. Я поспрашивал о нем — отзывы скорее негативные. Тогда попросил его сделать у нас доклад о его работах. Прослушав доклад, я сразу принял решение взять его в ИБГ. С тех пор работает у нас заведующим лабораторией. В 2019 году его избрали членом- орреспондентом РАН.
Соболев разработал новую технологию доставки лекарств к местам их действия в ядре или цитоплазме клеток, что позволяет пытаться лечить разные заболевания. Основное направление работ было связано с терапией онкологических заболеваний. Для этого создаются с помощью генной инженерии искусственные белки, состоящие из серии функциональных модулей, связанных пептидными мостиками. Они названы модульными нанотранспортерами (МНТ). Один модуль связывает лекарственный агент, например, радиоизотоп, другой доставляет МНТ к опухолевой клетке, третий вводит его в цитоплазму, а четвертый в ядро опухолевой клетки, где МНТ и осуществляет свое разрушительное действие.
Проблемы с внедрением — те же, что у меня. Технология успешно прошла доклинические испытания в Онкологическом институте имени Герцена. Однако, поскольку МНТ изготовлял сам Соболев, а не сертифицированное учреждение, они не были засчитаны. А затем государство продало предприятие, поставлявшее нужный изотоп, частнику, который прекратил его выпуск, как недостаточно рентабельного.
Сейчас Соболев работает над созданием МНТ, носителя другого изотопа, при поддержке «Росатома». Потеряно как минимум три года. Обидно.
Жизнь удалась
В целом я вполне доволен своей научной карьерой. Практически мне удалось не упустить предоставленных возможностей для открытий. Ситуации, чреватые открытиями, возникают часто в тех случаях, когда появляются противоречия между двумя группами надежных фактов. Это имело место при открытии информационной РНК и при расшифровке структуры ядерных РНП частиц.
Пожалуй, единственно обидным было то, что мы прошли мимо расшифровки структуры основной субъединицы хроматина, нуклеосомы. Она оказалась идентичной той нуклеопротеидной структуре, которую мы ранее обнаружили для пре-мРНП. Мы даже видели иногда глобулярные образования в электронном микроскопе, но я счел их артефактом. Так что виноват сам. Других подобных упущений не было.
В настоящее время в разных лабораториях ИБГ РАН проводится много важных фундаментальных исследований. Ведется активная работа по механизмам регуляции экспрессии генов. Открыты новые функции одного из основных регуляторных элементов генома, инсуляторов. Открыта целая серия белковых факторов, участвующих в контроле синтеза и транспорта мРНК. Открыты дальние взаимодействия в геноме, зависящие от трехмерной организации хромосом. Существенные результаты получены в области молекулярной иммунологии. Все эти результаты получены впервые в мире. Таким образом, ИБГ находится на передовых позициях и в фундаментальной и в прикладной науке.
Если говорить о семейной жизни, она у меня тоже сложилась очень счастливо. Жена Анастасия Некрасова, врач кардиолог. Мы познакомились, когда мне было 16 лет, а женился я в 22 года. Настя была высокодуховным человеком. Если я делал в жизни какие-то добрые дела, инициатива исходила от нее. Она вообще оказывала на меня большое влияние. Всегда поддерживала в трудные минуты жизни. Работая в Институте кардиологии, она защитила докторскую диссертацию, но всегда больше тяготела к практической работе врача. У нее была большая частная практика, причем ни с одного пациента она не брала ни копейки. Это счастье, что я всегда перед собой видел такой образец. Скончалась она недавно, на 93-м году жизни.

 Анастасия Александровна Некрасова (в центре) с Френсисом Криком и его женой Одил на вокзале в Кембридже (Англия).
Анастасия Александровна Некрасова (в центре) с Френсисом Криком и его женой Одил на вокзале в Кембридже (Англия).
У нас с нею двое детей, они оба молекулярные биологи, оба стали академиками. Я никогда не зазывал их в биологию, старался не влиять на их выбор. Они просто видели на нашем примере, что это интересно, вот и пошли в биологию. На выборах в Академию я был для них скорее негативным фактором.
Я доволен своими детьми. Они оба молодцы, труженики. У дочери, конечно, этот путь был труднее — у нее двое детей, так что она стала активно заниматься наукой позднее. Сын Павел сейчас директор этого института. Дочь София — директор Института молекулярной биологии им. В.А. Энгельгардта.
 София Георгиева
София Георгиева
 Павел Георгиев
Павел Георгиев
Подготовила Наталия Лескова


 Меню
Меню





 Все темы
Все темы




 0
0