Противоопухолевый эффект вакцины БЦЖ зависит от активации макрофагов
Вакцину БЦЖ давно используют для борьбы с раком мочевого пузыря, но механизм действия остается не до конца понятным. Работа с мышиными моделями дорогостоящая, длительная и не всегда эффективная. Ученые из Эквадора, Португалии и Германии вводили клетки рака мочевого пузыря и вакцину БЦЖ рыбкам данио. Оказывается, вакцина рекрутирует макрофаги к опухоли и индуцирует ее апоптоз. Макрофаги приобретают воспалительный фенотип; также повышается уровень некоторых провоспалительных цитокинов.
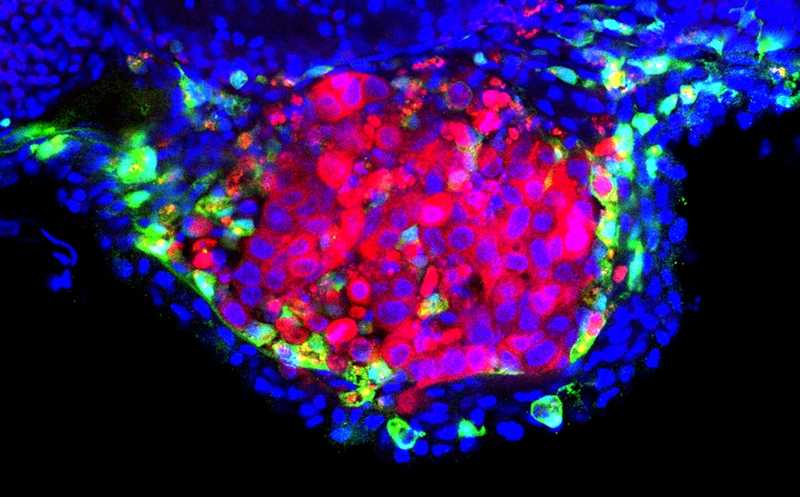
Credit:
Mayra Martinez-López et al., Disease Models and Mechanisms 2024 | Пресс-релиз
Вакцину БЦЖ (сокр. от Бацилла Кальмета — Герена) применяют не только для борьбы с туберкулезом, но и при раке мочевого пузыря. Вакцину вводят напрямую в пузырь. Если лечение работает, то 15-летняя выживаемость у пациентов с неинвазивным раком составляет 60–70%. Но в 30–50% случаев рак не отвечает на терапию. Тогда требуется резекция мочевого пузыря. Более того, у лечения есть побочные эффекты, а сама вакцина не всегда доступна. Не до конца понятен механизм противоопухолевого эффекта вакцины БЦЖ. Некоторые исследования показали, что важную роль играет местная воспалительная реакция в мочевом пузыре и активация врожденного и адаптивного иммунного ответа.
Чтобы изучить механизм иммунотерапии БЦЖ, нужна животная модель рака мочевого пузыря. Но при использовании мышей с ксенографтами ученые сталкиваются с рядом сложностей. Так, нужны мыши с подавленным иммунитетом или гуманизированые; требуется большое количество опухолевых клеток донора; работа с мышами требует времени и денежных затрат, а в клинических испытаниях только небольшая часть разработанных на этой модели лекарств хорошо работает.
В новой работе исследователи из Эквадора, Португалии и Германии использовали рыбок данио. Опухолевые клетки вводят в эмбрион или взрослую рыбку, и довольно быстро наблюдают пролиферацию, ангиогенез, метастазы и формирование опухолевого микроокружения. Все это можно визуализировать благодаря прозрачности модели. Ранее авторы использовали эту модель в том числе для предсказания ответа на терапию у пациентов с колоректальным раком. Новое исследование посвящено ранним механизмам иммунотерапии БЦЖ при раке мочевого пузыря.
Для создания ксенографта авторы взяли две клеточные линии рака мочевого пузыря. Одну изолировали из неинвазивной опухоли, другую — из распространившегося на мышцы рака мочевого пузыря. Бактерии метили красителем. Раковые клетки тоже метили флуоресцентными метками и вводили рыбкам на второй день после оплодотворения. Через день после введения клеток модель лечили БЦЖ. Процедуру повторяли через три дня и проводили анализ еще через день. Контролям вводили раствор PBS вместо БЦЖ. В течение первой недели развития рыбок у них активен только врожденный иммунитет, что облегчает изучение его реакций.
БЦЖ инициировала очищение модели от опухолевых клеток. С клетками неинвазивного рака процесс шел эффективнее. Анализ механизма показал, что БЦЖ активирует апоптоз опухолевых клеток. Сама по себе вакцина не была токсичной для раковых клеток in vitro, то есть дело было в иммунитете.
Авторы подсчитали число нейтрофилов и макрофагов, инфильтрующих опухоль, предварительно их пометив. Абсолютное кисло нейтрофилов не отличалось при введении БЦЖ и контрольного раствора. Напротив, число инфильтрующих макрофагов значительно выросло под действием БЦЖ. Авторы подтвердили, что макрофаги имели провоспалительный фенотип.
При искусственном снижении числа макрофагов апоптоз опухолевых клеток под действием БЦЖ не происходил. То есть раковые клетки уничтожаются макрофагами, противоопухолевая активность которых увеличивается за счет БЦЖ.
Затем активность стандартной вакцины БЦЖ сравнили с кандидатной вакциной БЦЖ нового поколения — VPM1002 (M. bovis BCGΔureC::hly). Она более иммунногенна, чем классическая вакцина. В настоящее время идет фаза 3 клинических испытаний этой вакцины для предотвращения туберкулеза в Африке и Индии.
И БЦЖ, и VPM1002 очистили организм рыбки от 45% опухолевых клеток. VPM1002 вызывала чуть более активную инфильтрацию макрофагов и апоптоз опухоли.
VPM1002 индуцировала экспрессию провоспалительных цитокинов tnfa (в 4 раза), il1b (в 3,3 раза) и il6 (в 2,8 раза). Также БЦХЖ стимулировала миелопоэз, но не гемопоэз в целом.
Введение вакцин без раковых клеток не повышало число иммунных клеток. Также введение ингибитора TNF пентоксифиллина подавляло процесс уничтожения раковых клеток с помощью вакцины.
Таким образом, сразу после введения вакцины БЦЖ макрофаги инфильтруют опухоль и приобретают провоспалительный фенотип. Это сопровождается активацией выработки нескольких провоспалительных цитокинов. Искусственное снижение числа макрофагов подавляет противоопухолевый эффект. И все эти процессы зависят от TNF-сигналинга.
Источник:
Mayra Fernanda Martínez-López, et al. Macrophages directly kill bladder cancer cells through TNF signaling as an early response to BCG therapy // Dis Model Mech (2024) 17 (8): dmm050693. 08 August 2024, DOI: 10.1242/dmm.050693


 Меню
Меню





 Все темы
Все темы




 0
0







