Развитию болезни Альцгеймера способствует белок медин
Роль белка медина в патогенезе болезни Альцгеймера была не до конца ясна. Ученые из Центра нейродегенеративных заболеваний в Германии установили, что медин может связываться с бета-амилоидом и способствует его агрегации. Это ведет к поражению сосудов мозга и нарушению питания нейронов. Возможно, в будущем удастся использовать медин как терапевтическую мишень.
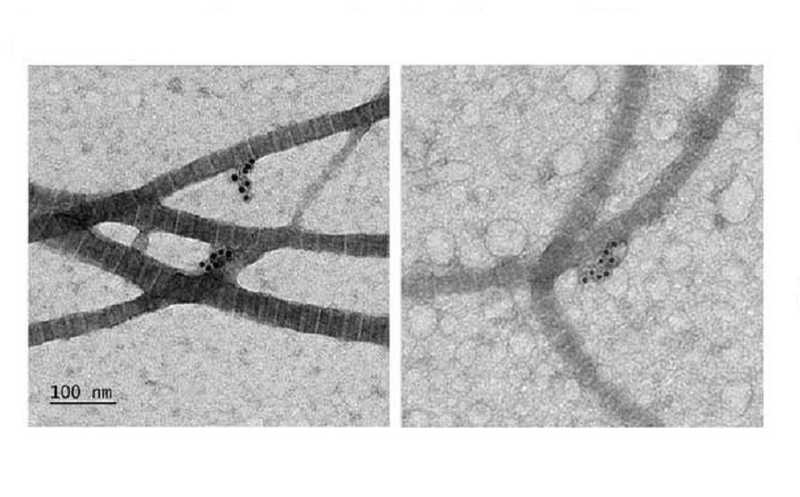
Агрегаты медина на коллагеновых волокнах аорты человека (иммуноэлектронная микроскопия)
Credit:
Nature. 2022. DOI: 10.1038/s41586-022-05440-3 | OA | CC BY 4.0
Как известно, в развитии болезни Альцгеймера (БА) важную роль играет отложение бета-амилоида в нейронах головного мозга. Это ведет к повреждению нервных клеток и их гибели. Но недавно ученые из Центра нейродегенеративных заболеваний Германии (DZNE) выяснили, что белок медин образует коагрегаты с бета-амилоидом и нарушает кровоснабжение клеток мозга при БА.
Медин, 50-аминокислотный пептид, отщепляемый по неизвестным механизмам от белка MFG-E8 — наиболее распространенный амилоидный белок человека. Агрегаты медина обнаруживаются в аорте и других артериях, повышает их жесткость и может вызывать цереброваскулярную дисфункцию. Есть данные об ассоциации медина в БА, однако неясно было, причина это или следствие.
Окрашивая антителами против медина образцы мозга мышей, трансгенных по белку-предшественнику амилоида и моделирующих БА, исследователи обнаружили, что этот белок локализуется в стенке сосудов мозга вместе с бета-амилоидом. Выключение гена медина у мышей приводило к снижению количества бляшек в мозге, хотя на общий уровень бета-амилоида не влияло. Исследователи предположили, что медин способствует агрегации бета-амилоида в стенках сосудов: бляшек образуются меньше, если его нет.
Ученые выделили сосуды мозга трансгенных мышей и определили уровень белка медина в них. Он был сильно повышен, причем с возрастом увеличивался и его уровень в тканях мозга. В свою очередь, выключение гена медина нарушало образование нерастворимого амилоида в сосудах.
Чтобы подтвердить участие медина в патогенезе БА, исследователи изучили аутоптаты мозга пациентов. Окрашивание ткани метокси-Х04 (флуоресцентный краситель — маркер бета-амилоида) выявило совместную локализацию медина и амилоида в структурах мозга, что соответствовало результатам исследований на мышах. В основном агрегаты располагались в стенках кровеносных сосудов. С помощью вестерн-блоттинга установили, что уровень медина в образцах мозга у пациентов с БА был повышен и при этом коррелировал с уровнем бета-амилоида. Затем ученые проанализировали экспрессию генов медина в образцах мозга. Оказалось, что она была повышена у людей с БА. Высокие уровни экспрессии выявлены в основном в гладкомышечных клетках и перицитах.
Взаимодействует ли медин с амилоидом напрямую? Иммуноэлектронная микроскопия ткани мозга мышей показала, что медин способствует образованию менее упорядоченных и более плотных амилоидных структур. А у мышей с выключенным геном медина амилоид был более «компактным», агрегаты имели более фибриллярную структуру. Кроме того, исследования in vitro подтвердили, что наличие медина способствовало более быстрой агрегации амилоида.
Чтобы выяснить, влияет ли медин на агрегацию амилоида in vivo, ученые выделили экстракт медина из образцов аорты пациентов и ввели его в гиппокамп мыши. Инъекция индуцировала выраженную агрегацию амилоида в ткани мозга в течение 6 месяцев.
Таким образом, эксперименты in vitro и in vivo подтверждают, что в развитии болезни Альцгеймера важную роль играет белок медин, который напрямую взаимодействует с амилоидом и способствует его агрегации. Недостаток медина нарушает образование амилоидных бляшек и препятствует поражению сосудов мозга. Возможно, медин станет новой терапевтической мишенью в борьбе с болезнью.
Ген APOE связан с агрегацией тау-белка при болезни Альцгеймера
Источник
Wagner J, et al. Medin co-aggregates with vascular amyloid-β in Alzheimer's disease // Nature. 2022 Nov 16. DOI: 10.1038/s41586-022-05440-3


 Меню
Меню





 Все темы
Все темы




 0
0








