Резистентность HER2-позитивного рака молочной железы к терапии можно преодолеть, воздействуя на TACC3
Приобретение устойчивости к лекарственным препаратам — серьезная проблема в терапии пациентов с раком молочной железы. Ученые из США исследовали механизм действия таргетных препаратов и обнаружили один из факторов лекарственной резистентности HER2-позитивного рака молочной железы — белок TACC3, стимулирующий митоз.
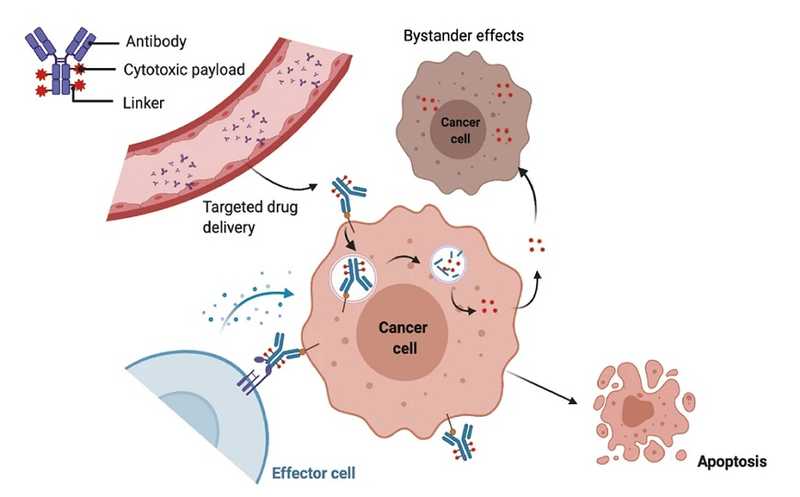
Механизм действия конъюгата антитело-лекарство
Credit:
Sig Transduct Target Ther (2022). DOI: 10.1038/s41392-022-00947-7 | CC BY 4.0 DEED
Рак молочной железы (РМЖ) — наиболее распространенное злокачественное новообразование и одна из ведущих причин смерти от онкологических заболеваний у женщин в мире. В молекулярной классификации рака молочной железы выделяют четыре подтипа, один из которых — с гиперэкспрессией белка HER2 — отличается от других тем, что имеет известную мишень для таргетной терапии. Внедрение в практику препаратов моноклональных антител (наиболее известный — трастузумаб) превратило этот тип РМЖ, изначально агрессивный, в относительно благоприятный вариант.
Впоследствии была создана другая группа препаратов — конъюгаты антитело-лекарство (antibody-drug conjugate, ADC), что сделало таргетную терапию HER2-позитивного рака молочной железы еще более эффективной. Несмотря на это, остается актуальной проблема развития устойчивости РМЖ к лекарственным средствам, даже таким избирательным, как моноклональные антитела. Новое исследование, результаты которого опубликованы в Cancer Research, продемонстрировало возможный способ преодоления резистентности — ингибирование белка TACC3.
Авторы исследования выдвинули гипотезу, согласно которой один из первых ADC — трастузумаб эмтанзин (T-DM1) — вызывает иммуногенную клеточную гибель. При этом из погибающей опухолевой клетки наружу выходят DAMP — молекулярные фрагменты, ассоциированные с повреждениями (damage-associated molecular patterns), которые активируют иммунные клетки и тем самым запускают противоопухолевый иммунный ответ. Чтобы подтвердить эту гипотезу, ученые инкубировали клеточные культуры HER2-позитивной опухоли молочной железы с T-DM1 и оценили уровень секретированных клетками маркеров иммуногенной клеточной гибели — p-eIF2α, DAMP (АТФ, HMGB1, поверхностный кальретикулин) и цитокинов. Уровень всех маркеров оказался повышен. Кроме того, исследователи показали, что индукция иммуногенной гибели клеток обусловлена действием цитотоксического компонента T-DM1 на контрольную точку веретена деления (spindle assembly checkpoint, SAC) с последующей остановкой митоза.
Далее ученые определили, что в клеточных линиях, резистентных к T-DM1, препарат не вызывал секрецию DAMP и других маркеров, то есть не индуцировал иммуногенную клеточную гибель. В поисках причины они сравнили результаты РНК-секвенирования чувствительных и устойчивых к трастузумабу эмтанзину клеточных культур и выделили несколько генов, экспрессия которых отличалась в разных культурах. Среди них внимание привлек ген TACC3, гиперэкспрессированный в резистентных клетках.
Белок TACC3 ассоциирован с веретеном деления и центросомами и стимулирует прохождение клетки через митоз. Повышенная экспрессия его гена была также подтверждена на белковом уровне и с помощью иммуногистохимии в образцах опухоли пациентов, резистентных к терапии трастузумабом эмтанзином.
Чтобы подтвердить роль TACC3 в приобретении устойчивости клеток РМЖ к T-DM1, авторы работы подавили его функцию с помощью малых интерферирующих РНК и фармакологических ингибиторов, а затем и методом геномного редактирования CRISPR-Cas9. Повышение уровня маркеров иммуногенной гибели в T-DM1-резистентных клетках свидетельствовало об участии TACC3 в подавлении этой формы апоптоза.
Наконец, ученые оценили эффективность комбинации трастузумаба эмтанзина и ингибитора TACC3 in vivo. Они привили мышам клетки T-DM1-чувствительной культуры HER-2 позитивного РМЖ и вводили им противоопухолевые препараты отдельно или в комбинации. Комбинация T-DM1 и ингибитора TACC3 полностью блокировала рост опухоли в отличие от этих же препаратов, введенных по отдельности разным группам мышей. Подобный эффект был достигнут и в опыте, в котором мышам одновременно вводили интактные T-DM1-резистентные клетки опухоли и такие же клетки, предварительно инкубированные с этими же препаратами отдельно или в комбинации, — выживаемость мышей была значительно выше в группе комбинированного применения препаратов.
Полученные данные открывают возможность для разработки новых терапевтических стратегий в лечении пациенток с HER2-позитивным раком молочной железы, резистентных к таргетной терапии.
Модифицированный трастузумаб подавляет метастазы в кости у мышей
Источник
Gedik, M. E., et al. Targeting TACC3 induces immunogenic cell death and enhances T-DM1 response in HER2-positive breast cancer // Cancer Research (2024), 2024. DOI: 10.1158/0008-5472.CAN-23-2812


 Меню
Меню





 Все темы
Все темы




 0
0








