Сигнальные пути Hippo и PI5PI4 совместно регулируют работу коактиватора транскрипции YAP
Ученые из США исследовали регуляцию сигнального пути Hippo, отвечающего за клеточный рост, и нашли новые мишени противораковой терапии. Ключевые киназы сигнального пути Hippo, MST1/2, ингибируют активность киназ PI5P4K, присоединяющих фосфатную группу к фосфоинозитиду PI5P. Тем самым блокируется активность белка YAP, отвечающего за пролиферацию раковых клеток. Следовательно, ингибиторы PI5P4K могут стать противораковыми препаратами.
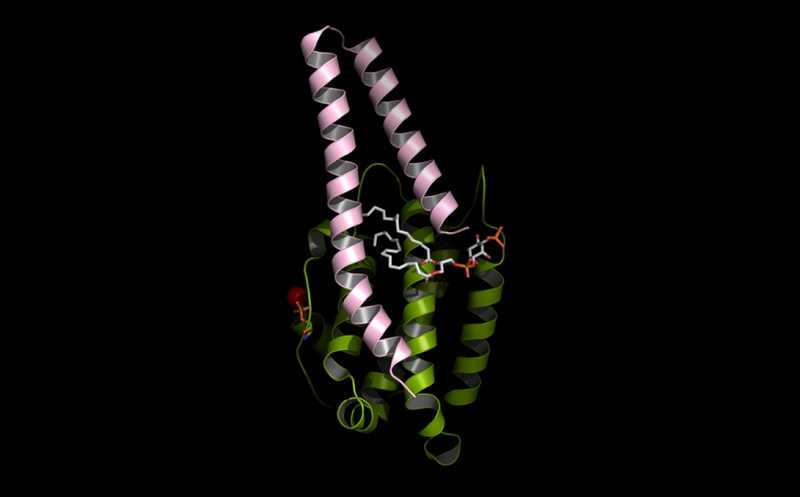
PI5P взаимодействует с комплексом двух компонентов Hippo — MOB1 (зеленый) и LATS1 (розовый). Это изображение поместили на обложку Science Signaling
Credit:
Пресс-релиз | Brooke Emerling | AlphaFold 2
Команда ученых из США впервые продемонстрировала, что активность 5-фосфат 4-киназ второго типа (PI5P4K) связана с древней системой регуляции клеточного роста и размера органов — сигнальным путем Hippo. Статья опубликована в Science Signaling.
«До сих пор наша лаборатория фокусировалась на том, что представляют собой эти ферменты, почему PI5P4K важны и как они влияют на рост опухолей, — говорит руководительница работы Брук Эмерлинг из некоммерческого исследовательского института Sanford Burnham Prebys (Ла Хойя, Калифорния). — Поскольку существует возможность нацелить на эти ферменты новые препараты для лечения рака, важно больше узнать о том, что они делают и как они регулируются».
Фосфоинозитиды — сигнальные молекулы, производные фосфатидилинозитола, которые влияют на множество клеточных процессов, включая пролиферацию, выживание и рост клеток, и нарушение этих путей регуляции часто встречается при раке и других заболеваниях. Сами фосфоинозитиды регулируются сетью киназ и фосфатаз, которые добавляют или удаляют фосфатные группы в определенных положениях. Активно исследуются фосфатидилинозитол-3-киназы (PI3K); фосфатидилинозитол-5-фосфат-4-киназы второго типа (PI5P4K), которые изучают Эмерлинг с коллегами, привлекают меньше внимания.
Субстратом для PI5P4K является фосфатидилинозитол-5-монофосфат (PI5P), при его фосфорилировании образуется фосфатидилинозитол-4,5-монофосфат (PI4,5P2). PI5P — один из наименее изученных фосфоинозитидов, его долгое время не могли связать с каким-либо сигнальным путем в клетке.
Некоторые фосфолипиды регулируют сигнальный путь Hippo, который состоит из четырех основных киназ: MST1 и MST2 и LATS1 и LATS2, а также ассоциированных адаптерных белков SAV и MOB1. Главная мишень сигнального пути Hippo, белок YAP, в свою очередь, активирует различные транскрипционные программы, связанные с ростом клеток. Нарушение регуляции YAP приводит к патологиям, включая рак и метастазы.
Ученые предположили, что MST1 и MST2 ингибируют активность PI5P4K, поэтому мутации MST киназ в раковых клетках могут быть причиной неконтролируемой пролиферации опухоли. Чтобы проверить эту гипотезу, они инкубировали киназу PI5P4Kβ с панелью протеинкиназ и АТФ. Затем добавили липидный субстрат PI5P и АТФ с радиоактивной меткой и измерили продукцию PI45P2 при помощи тонкослойной хроматографии. MST1 наиболее эффективно ингибировала активность PI5P4Kβ, а также другой изоформы – PI5P4Kα.
Авторы получили при помощи CRISPR Cas9 нокаутные по MST1 и MST2 клетки человеческой эмбриональной почки. В них значительно выросло количество внутриклеточного PI4,5P2 по сравнению с клетками дикого типа (WT), таким образом, гипотеза подтвердились и на клеточном уровне.
Известно, что активация комплекса MOB1-LATS приводит к фосфорилированию YAP и мешает его ядерной транслокации. Авторы статьи установили, что активация PI5P4K снижает взаимодействие между ключевыми белками Hippo MOB1 и LATS и стимулирует запуск генетической программы, управляемую YAP, которая контролирует эпителиально-мезенхимальный переход. Снижение экспрессии или нокаут PI5P4K усиливали активность белков-мишеней MST1/2 и снижали активность YAP. Также было показано, что PI5P взаимодействует с MOB1 и усиливает его взаимодействие с LATS, обеспечивая тем самым связь между сигнальными путями Hippo и PI5P4K.
Чтобы оценить возможную значимость взаимодействия PI5P4K-Hippo для лечения рака, ученые проанализировали корреляцию между экспрессией YAP и PIP4K2A у пациентов с инвазивным раком молочной железы из базы данных Cancer Genome Atlas Pan-Cancer Atlas. Увеличение экспрессии PIP4K2A положительно коррелировало с экспрессией YAP, а также генов-мишеней YAP (CCN2, CCN1, AXL и SLIT2). Ассоциация была показана и для других видов рака, а именно рака яичников, колоректальной аденокарциномы, рака предстательной железы и рака головы и шеи.
«Эти результаты вызывают восторг», — отмечает Брук Эмерлинг. Hippo — один из основных путей, которые нарушаются при раке, YAP используется как биомаркер агрессивных опухолей, делаются попытки создать нацеленные на YAP препараты. Но альтернативой может быть ингибирование PI5P4K. Эмерлинг добавила, что уже разработаны несколько ингибиторов, которые могут быть использованы в будущих исследованиях.
Авторы планируют смоделировать липидные и белковые взаимодействия для лучшего понимания пересечения PI5P4K и Hippo путей, а также измерить влияние ингибиторов PI5P4K на активность YAP в моделях опухолей у мышей, чтобы определить возможную пользу их находки для онкобольных.
Источники
Lavinia Palamiuc et al.,Hippo and PI5P4K signaling intersect to control the transcriptional activation of YAP // Science Signaling.17,eado6266 (2024).DOI: 10.1126/scisignal.ado6266
Цитаты по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0








