Система редактирования генома, включаемая инфракрасным светом, убивает клетки рака
Китайские исследователи сконструировали систему доставки CRISPR-Cas9 в клетки, которая дает возможность активировать редактирование генома с помощью инфракрасного света.
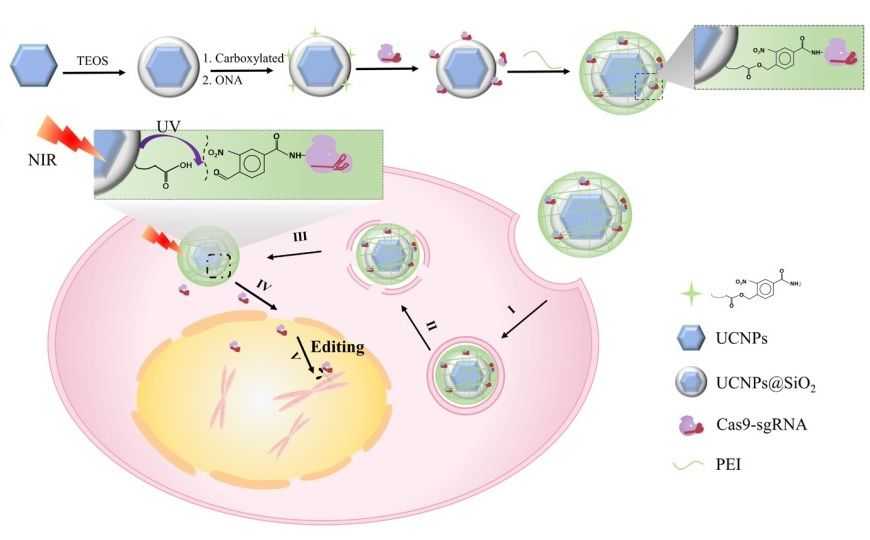
Одна из главных проблем с применением CRISPR-Cas9 для редактирования многоклеточных систем — доставка: как поместить в клетки довольно крупный молекулярный комплекс, причем именно в те клетки, которым требуется редактирование. Последнее время в качестве средства доставки вместо вирусных векторов все чаще рассматриваются органические и неорганические наноматериалы. Но при этом приходится решать проблему контролируемого высвобождения нуклеазы.
Идеальный способ высвободить CRISPR-Cas9 в нужном месте и в нужное время — фоторегуляция. Известно много молекул, которые расщепляются под действием ультрафиолетового излучения, однако ультрафиолет неглубоко проникает в ткани и вреден для организма. С другой стороны, живые ткани практически прозрачны для ближнего инфракрасного излучения (700—1000 нм), и оно безопасно.
Китайские исследователи сконструировали систему доставки CRISPR-Cas9, которая реагирует на ближний инфракрасный свет. Система использует наночастицы с лантаноидом, повышающие частоту излучения (upconversion nanoparticles, UCNP), которые преобразуют инфракрасный свет (980 нм) в ультрафиолет. Местное ультрафиолетовое излучение расщепляет светочувствительную молекулу, пришивающую CRISPR-Cas9 к наночастице, что делает возможным редактирование.
После того как авторы убедились, что наночастицы и ИК-излучение не влияют на жизнеспособность клеток, они проверили эффективность редактирования. Для эксперимента они выбрали гидовую РНК, таргетирующую ген полоподобной киназы 1 (PLK1), ассоциированный со многими видами рака. Метод испытали сначала in vitro, на человеческих клетках аденокарциномы в культуре. Обработка наночастицами, несущими CRISPR-Cas9, с последующим ИК-облучением вызывала в культуре апоптоз. Эффективность in vivo проверяли на мышах, которым были трансплантированы те же клетки аденокарциномы. Препарат вводили внутрь опухоли, затем облучали этот участок инфракрасным светом. По сравнению с контролем ежедневно по 20 мин рост опухоли существенно замедлился, при этом побочных эффектов у животных не наблюдалось.
Авторы отмечают, что при внутривенном введении содержание наночастиц в опухоли оказалось недостаточным для терапии. Однако в дальнейшем систему можно будет дополнить средствами адресной доставки в раковые клетки.


 Меню
Меню





 Все темы
Все темы




 0
0