Структура вместо ферментативной активности: как CaMKII участвует в долговременной потенциации
Ученые из США показали, что для формирования долговременной потенциации не требуется ферментативная функция киназы CaMKII, как считалось ранее. Для этого процесса достаточно структурной функции белка — связывания с одной из субъединиц NMDA-рецептора. Результаты могут повлиять на будущую разработку терапий заболеваний, затрагивающих долговременную потенциацию, таких как болезнь Альцгеймера.
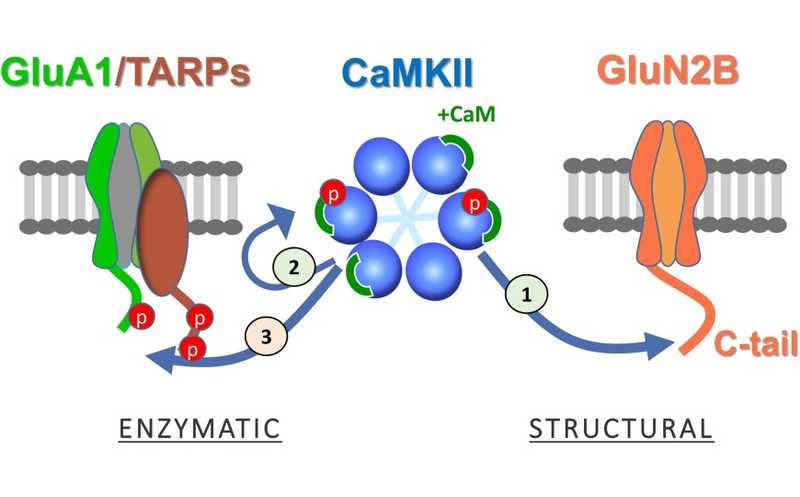
Для индукции долговременной потенциации достаточно структурных функций CaMKII (1). Для их реализации требуется аутофосфорилирование CaMKII в сайте T286, но ингибиторы связывания АТФ заменяют аутофосфорилирование и усиливают связывание с GluN2B субъединицей NMDA-рецептора (2). При этом фосфорилирование CaMKII внешних субстратов не требуется для индукции LTP (3).
Credit:
Nature (2023). DOI:
10.1038/s41586-023-06465-y |
CC BY
Долговременная потенциация (LTP) — усиление синаптической связи между нейронами в ответ на передачу сигнала — предположительно играет ключевую роль в формировании памяти. До сих пор считалось, что LTP требует ферментативной активности Ca2+/кальмодулин зависимой протеинкиназы (CaMKII). Опубликованное учеными из США исследование показало, что для формирования LTP на самом деле достаточно структурной функции CaMKII, а именно ее связывания с GluN2B субъединицей NMDA-рецептора, который играет важную роль в синаптической пластичности.
Фотоактивация CaMKII способствует долговременной потенциации в нейронах гиппокампа даже в отсутствие нервного сигнала. Однако, как и при активации Ca2+/кальмодулин комплексом, при фотоактивации для взаимодействия открывается не только сайт связывания субстрата на CaMKII (S-сайт), но и сайт, взаимодействующий с GluN2B (T-сайт). Авторы пометили CaMKII и GluN2B флуоресцентными белками и фотоактивировали CaMKII. Оказалось, что при этом происходила колокализация CaMKII с GluN2B. Их связывание также подтвердили специальными панелями для анализа взаимодействия белков. В нейронах гиппокампа мыши связывание GluN2B с CaMKII необходимо для транспорта последнего в дендритные шипики, что служит для формирования LTP. Мутации CaMKII или GluN2B, препятствующие связыванию этих белков, нарушали транспорт CaMKII в дендритные шипики и рост самих шипиков.
Авторы протестировали два ингибитора CaMKII — AS105 и AS283 — которые блокируют сайт связывания АТФ на белке. Оба вещества успешно блокировали ферментативную, но не структурную (связывание с GluN2B) функцию CaMKII. Это позволило ученым использовать AS283 (более доступное из двух веществ) для изучения структурной функции белка в отрыве от его ферментативной активности.
Оказалось, что воздействие AS283 на нейроны гиппокампа мышей дикого типа не препятствовало формированию LTP. Такие результаты оказались крайне неожиданными для исследователей, так как считается, что как минимум одна ферментативаная реакция — аутофосфорилирование CaMKII на сайте T286 — необходима для долговременной потенциации. Таким образом, либо AS283 неэффективно блокирует ферментативную функцию, либо сам по себе устраняет необходимость в аутофосфорилировании CaMKII.
Авторы посчитали, что если последнее предположение верно, то AS283 должен восстанавливать способность к LTP у мышей с мутацией T286A, которая препятствует аутофосфорилированию на данном сайте. И действительно, именно такое явление наблюдалось в рамках проведенных экспериментов. Дальнейшие опыты показали, что AS283 не только не препятствует связыванию CaMKII с GluN2B, но и способствует ему, замещая фосфорилирование T286 в этом процессе. Дальнейшие опыты показали: такой эффект AS283 обусловлен тем, что он блокирует фосфорилирование GluN2B на сайте S1303, входящем в сайт связывания с CaMKII.
Для дополнительного подтверждения того, что для формирования LTP достаточно структурной функции CaMKII, авторы провели ряд опытов на нейронах гиппокампа, несущих мутацию F89G. Сама по себе мутация оказалась крайне полезным инструментом для исследования — она модифицирует сайт связывания АТФ, что позволяет применять АТФ-конкурентный ингибитор NM-PP1. Она также снижает ферментативную активность CaMKII и способность к связыванию с GluN2B. При этом воздействие NM-PP1 на нейроны с такой мутацией окончательно ингибирует ферментативную функцию CaMKII, но восстанавливает связывание с GluN2B. В опытах на срезах гиппокампа, несущих мутацию F89G, ученые продемонстрировали потерю способности формировать LTP и восстановление этой способности под действием NM-PP1.
Наконец, авторы показали, что клетки с мутацией T286A в присутствии AS283 и клетки с мутацией F89G в присутствии NM-PP1 способны к формированию дендритных шипиков — основного структурного признака LTP.
Проведенная работа представила множественные свидетельства того, что для формирования долговременной потенциации в нейронах гиппокампа достаточно структурной функции CaMKII — связывания с GluN2B. Ферментативная функция CaMKII оказалась не критичной для формирования LTP, как считалось ранее. Полученные результаты могут повлиять на подход к будущим разработкам терапий заболеваний, затрагивающих долговременную потенциацию, таких как болезнь Альцгеймера.
Источник
Tullis, J.E. et al. LTP induction by structural rather than enzymatic functions of CaMKII // Nature (2023). DOI: 10.1038/s41586-023-06465-y


 Меню
Меню





 Все темы
Все темы




 0
0








