Теломерные последовательности внутри хромосомы — источник геномной нестабильности
Теломерные повторы встречаются не только на концах хромосом, но и во внутренних регионах — такие участки называются интерстициальными теломерными последовательностями. Они подвержены разрывам и провоцируют хромосомные перестройки. В журнале Cell Biology опубликовано исследование, посвященное стабильности интерстициальных теломерных последовательностей в клетках дрожжей. Его авторы описали целый спектр механизмов, контролирующих хромосомные перестройки в таких участках.
При репликации теломер — концевых участков хромосом —возникают некоторые трудности. Во-первых, ДНК-полимеразы не могут полностью реплицировать теломерные последовательности в силу особенностей этих ферментов («проблема концевой репликации»). Другая сложность связана с обрывом и разрушением репликативных вилок при прохождении теломер, что ведет к их укорочению и дисфункции. Эти затруднения распространяются в том числе и на так называемые интерстициальные теломерные последовательности (ITS) — теломерные повторы, которые встречаются прямо внутри хромосом. Именно эти ITS представляют особую опасность для геномной стабильности, поскольку они подвержены разрывам, провоцируют перестройки генома и часто встречаются в точках разрыва при транслокациях в опухолевых клетках. Кроме того, в случае обрыва хромосомы во время репликации в месте ITS он может быть «залечен» теломеразой. Это приведет к образованию новой теломеры и потере генетического материала, оказавшегося в части хромосомы после точки обрыва, что может стать причиной различных патологий.
Ученые из Нидерландов количественно измерили стабильность ITS в дрожжах Saccharomyces cerevisiae с помощью анализа грубых хромосомных перестроек (gross chromosomal rearrangements, GCR) и установили механизмы, с помощью которых ITS способствуют их образованию.
Для этого в дрожжевые клетки вносили ITS различной длины. Их встраивали в пятую хромосому между PCM1 — жизненно важным геном, который участвует в регуляции клеточного цикла и деления, — и двумя селективными маркерами. Один из них, CAN1, кодирует белок, ответственный за транспорт аминокислоты аргинина, и мутации в этом гене делают клетки устойчивыми к определенным токсичным соединениям, таким как канаванин (аналог аргинина). Другой маркер, ген URA3, кодирует фермент, участвующий в синтезе урацила. Клетки с мутацией в URA3 не способны самостоятельно производить урацил, поэтому для роста требуют его наличия в среде. Скорость накопления GCR (количество GCR, приходящихся на одно деление клетки) можно определить по скорости одновременной потери CAN1 и URA3, измеряемой при росте в среде, содержащей канаванин и 5-фторурациловую кислоту.
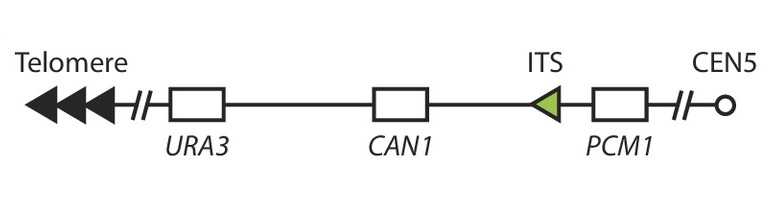 Схема расположения маркерных генов, между которыми встраивали ITS.
Схема расположения маркерных генов, между которыми встраивали ITS.Credit:
PNAS (2024). DOI: 10.1073/pnas.2407314121 | CC BY
Выяснилось, что скорость накопления GCR экспоненциально растет с увеличением длины ITS — резко при длине вставок до 50 п.н. и более плавно при встраивании более длинных ITS. Это объясняется, во-первых, тем, что чем длиннее ITS, тем больше сама вероятность возникновения хромосомной перестройки. Во-вторых, чтобы разрыв в ITS был распознан именно как критически короткая теломера и «отремонтирован» теломеразой, на оборванном конце хромосомы должно остаться не менее 34 п.н. теломерной последовательности, иначе будет запущен альтернативный механизм репарации двуцепочечного разрыва ДНК. Чем длиннее ITS, тем больше вероятность, что разрыв произойдет внутри нее и что оставшаяся после него на конце хромосомы теломерная последовательность будет не менее 34 п.н. При определенной же длине ITS почти все разрывы будут происходить внутри нее, причем будут оставлять не менее 34 п.н. теломерной последовательности — из-за этого дальнейшее увеличение ее длины уже не так резко влияет на скорость накопления GCR.
Далее ученые внедряли мутантные тепломерные последовательности, у которых нарушено взаимодействие с Rap1 — белком, связывающим теломерные повторы. Эти опыты показали, что он играет важную роль в восстановлении разрывов ДНК внутри ITS или дальше к концу хромосомы по пути добавления теломер de novo, однако доминирующую роль все же играет граница длины, по которой клетка отличает двуцепочечный разрыв ДНК от критически короткой теломеры.
Геномный скрининг выявил гены, способствующие увеличению скорости ITS-индуцированного накопления GCR. Большинство из них задействованы в репликации ДНК. При этом многие гены, которые предположительно должны снижать количество GCR, не проявляли ожидаемого эффекта при наличии ITS. Таким геном оказалась, например, хеликаза Rrm3, способствующая продвижению вилки репликации через теломерные последовательности. Кроме того, в присутствии ITS делеция EST1, EST2 или EST3, которые кодируют субъединицы теломеразы, снижает скорость накопления GCR примерно в 300 раз. Также в образовании GCR участвуют некоторые белки Rad, необходимые в норме для эксцизионной репарации нуклеотидов и репликации.
Таким образом, геномная нестабильность, зависящая от интерстициальных теломерных последовательностей, определяется множеством факторов, которые способствуют или препятствуют образованию хромосомных перестроек в этих участках.
Механизм хромосомных перестроек у дрожжей подсказал стратегию противоопухолевой терапии
Источник
F.R. Rosas Bringas, et al., Interstitial telomeric sequences promote gross chromosomal rearrangement via multiple mechanisms, // Proc. Natl. Acad. Sci. U.S.A. 121 (49) e2407314121, (2024). DOI: 10.1073/pnas.2407314121


 Меню
Меню





 Все темы
Все темы




 0
0








