Точечные мутации накапливаются в ведущей и отстающей цепях ДНК одинаково быстро
Повреждение оснований ДНК — одна из основных причин онкогенных мутаций. Группа под руководством немецких ученых показала, что, несмотря на различия в репликации ведущей и отстающей цепей, обе они накапливают повреждения с сопоставимой скоростью, а мутации в значительной степени формируются под влиянием доступности ДНК, а не места повреждения. Кроме того, участки генома, которые репарируются наиболее интенсивно, чаще подвергались мутациям в мышиной модели канцерогенеза, и авторы работы предложили механизм, связывающий эксцизионную репарацию с усиленным мутагенезом.
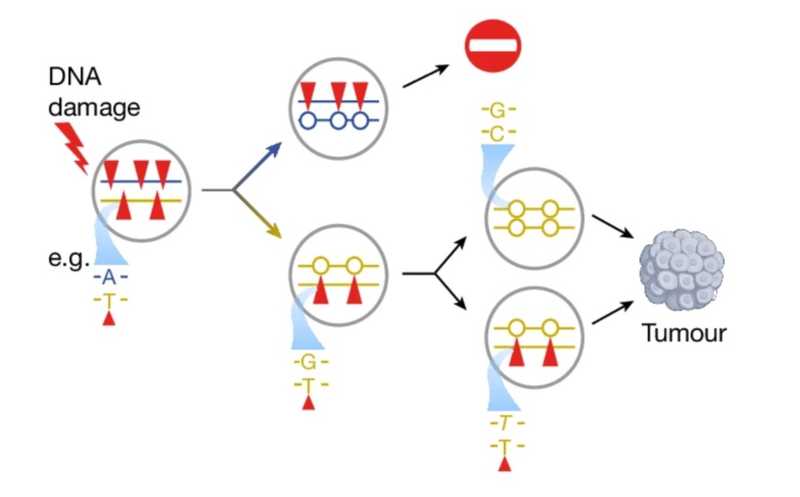
Повреждения ДНК, вызванные мутагеном, формируются на ведущей (синяя) и отстающей (желтая) цепях. Сестринские хроматиды разделяются между дочерними клетками, и новые мутации не передаются между дочерними клетками после первого деления. Повреждения, сохраняющиеся в течение нескольких клеточных поколений, могут формировать мультиаллельные вариации за счет повторной репликации через повреждение.
Credit:
Nature (2024). DOI:
10.1038/s41586-024-07490-1 |
CC BY
Несмотря на симметрию структуры ДНК, многие процессы в ней асимметричны и специфичны для цепи. Так, во время репликации разные ферменты преимущественно синтезируют лидирующую и отстающую цепи, транскрипция РНК использует только одну цепь ДНК в качестве шаблона, одна сторона двойной спирали ДНК сильнее ассоциирована с транскрипционными факторами. Все это в случае нарушения может привнести ассиметричные мутации в дочернюю ДНК.
Геномы раковых клеток характеризуются большим количеством мутаций, часто накопленных в течение десятилетий, что затрудняет определение ролей отдельных мутаций в развитии опухоли. До сих пор вклад повреждения и репарации ДНК в создание пространственной и временной асимметрии практически не изучен.
Специалисты из Немецкого центра исследования рака (DKFZ) вместе с коллабораторами из университетов Кембриджа и Эдинбурга изучили роль механистической асимметрии повреждений и репарации ДНК в масштабе всего генома, используя мышиную модель канцерогенеза печени, в которой мутации индуцируются через однократное воздействие алкилирующего агента диэтилнитрозамина (DEN). Возникающие при этом повреждения оснований ДНК наследуются в дальнейших клеточных циклах в виде мутаций. Поврежденная цепь ДНК наследуется одной из дочерних клеток, что позволяет проследить судьбу этой цепи в опухоли. Такое явление известно как сегрегация повреждений.
Ученые проанализировали данные 237 опухолей у 98 мышей и смогли идентифицировать поврежденную цепь для более чем семи миллионов нуклеотидных замен. Исследователи предположили, что из-за асимметричности репликационной вилки лидирующая и отстающая цепи будут иметь разную скорость возникновения мутаций. Однако, вопреки ожиданиям, эксперименты показали лишь незначительные различия в скорости образования мутаций, указывая на возможную роль других механизмов в развитии асимметричности.
Ориентация генов — и, следовательно, направление транскрипции — также коррелирует с направлением репликации, и повреждения, вызванные алкилирующими агентами, подлежат репарации, сопряженной с транскрипцией (TCR). Авторы статьи проанализировали транскриптом печени 15-дневных мышей — эти сроки соответствуют времени мутагенеза, вызванного диэтилнитрозамином. Анализ подтвердил, что направление транскрипции сильно смещено в сторону движения репликационной вилки, не влияя на симметричность мутаций в самой вилке.
Чтобы отделить влияние транскрипции от репликации, ученые измерили частоту мутаций, стратифицировав участки генома по транскрипционному статусу, смещению нитей репликации, времени репликации и аннотации генов. Корреляция между частотой мутаций и временем репликации присутствовала, указывая на работу механизмов репарации ошибочно спаренных нуклеотидов, однако роль последней оказалась незначительна по сравнению с TCR.
Полученные результаты указывают на общий механизм обхода повреждений для ведущей и отстающей цепей с привлечением одних и тех же трансляционных полимераз с одинаковой эффективностью и процессивностью. Это резко контрастирует с асимметричной устойчивостью цепей к более объемным повреждениям, вызванными ультрафиолетовым облучением.
Хотя смещение репликационных цепей не влияет на частоту мутаций от алкилирующих повреждений, как транскрипция, так и доступность ДНК имеют большое влияние. Изучив кинетику репарации и картировав ландшафт доступности ДНК с помощью ATAC-seq, исследователи обнаружили, что мутации, вызванные повреждениями ДНК, в значительной степени формируются под влиянием доступности ДНК, а не места возникновения повреждений.
Интересно, что регионы генома, которые наиболее эффективно «ремонтируются», оказались более склонны к мутагенезу, индуцированному репарацией. Эксперименты показали, что эксцизионная репарация нуклеотидов (NER), сопряженная с транскрипцией, может приводить к возникновению мутаций, в том числе ассиметричных, особенно в участках с большой мутационной нагрузкой, и провоцировать развитие рака.
Авторы работы предположили механизм мутагенеза, опосредованного NER. Когда на противоположных цепях ДНК в непосредственной близости возникают два повреждения, исправление одного из них влечет за собой вырезание одноцепочечного фрагмента длиной примерно 26 нт. Оставшаяся одноцепочечная брешь при этом содержит второе повреждение, и достраивание цепи будет происходить через него. Ученые назвали этот механизм мутагенезом, индуцированным ресинтезом через повреждение (translesion resynthesis-induced mutagenesis, TRIM), или NER-TRIM в контексте NER. Они показали, что NER-TRIM может индуцировать онкогенез, причем распределение мутаций между дочерними клетками в таком случае будет симметричным.
Долгое время предполагалось, что асимметрия репликации на ведущей и отстающей цепях ДНК приведет также к асимметричному мутагенезу, и это предположение подтверждалось анализом мутаций, вызванных УФ-облучением. Однако результаты этой работы ставят под сомнение такую модель — точечные мутации в проведенных опытах накапливались на ведущей и отстающей цепях с сопоставимыми скоростями. Проведенная работа уточняет роль асимметричных механизмов формирования, устойчивости и репарации повреждений ДНК в эволюции ракового генома.
Белок репарации бактерий сам вызывает мутации
Источник
Anderson, C.J. et al., Strand-resolved mutagenicity of DNA damage and repair. // Nature (2024). DOI: 10.1038/s41586-024-07490-1


 Меню
Меню





 Все темы
Все темы




 0
0








