Трансплантация «суперостровков Лангерганса» лечит диабет
Трансплантация бета-клеток, вырабатывающих инсулин, — проверенный временем метод лечения диабета первого типа. Однако он не лишен недостатков — после трансплантации большое количество пересаженных клеток гибнет. Разработан новый метод, при котором бета-клетки пересаживаются вместе с клетками амниотического эпителия, что помогает им выжить.
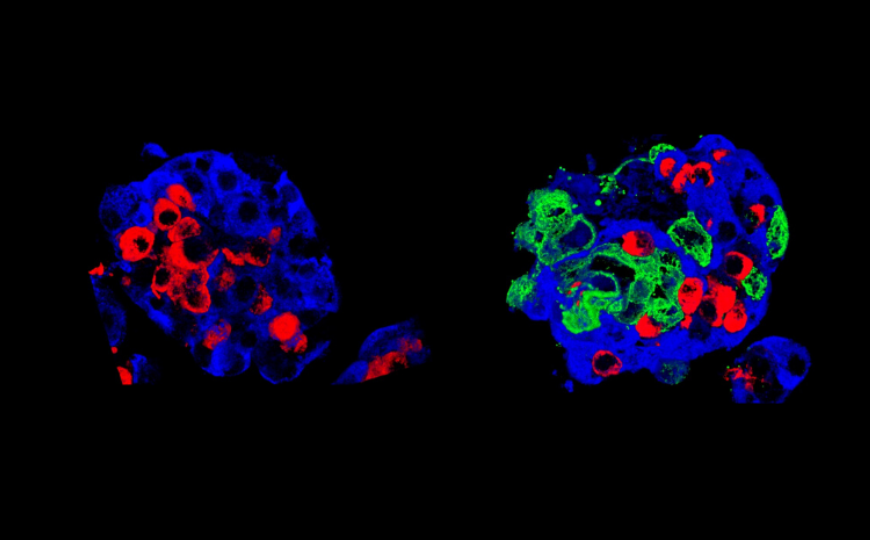
Слева: стандартный островок Лангерганса, справа — «суперостровок». Синий цвет — бета-клетки, красный — альфа-клетки, производящие глюкагон; «суперостровок» содержит, кроме того, клетки амниотического эпителия (зеленый).
Credit: Пресс-релиз UNIGE
Диабет первого типа вызван неспособностью организма вырабатывать гормон инсулин, необходимый для регулирования углеводного обмена и других важных метаболических процессов (в отличие от диабета второго типа, когда инсулин вырабатывается, но недостаточно эффективен). В норме инсулин продуцируют эндокринные бета-клетки поджелудочной железы, скопления этих клеток образуют так называемые островки Лангерганса. При пересадке кластеров функциональных бета-клеток пациенту, болеющему диабетом, довольно много клеток гибнет. Происходит это в основном из-за плохой васкуляризации (недостаточном росте сосудов) в пересаженной ткани, а также из-за локального воспаления и отторжения трансплантата. Кроме того, бета-клетки плохо переносят гипоксию, с которой им приходится сталкиваться на начальных этапах трансплантации.
Коллектив исследователей из Австралии, Грузии, Италии, Франции и Швейцарии разработал новую методику трансплантации бета-клеток и проверил ее в экспериментах на мышах. Результаты работы опубликованы в журнале Nature Communications.
Новаторским шагом былa трансплантация органоида, состоящего из клеток нескольких типов — эндокринных бета-клеток и клеток амниотического эпителия (КАЭ). Известно, что КАЭ секретируют противовоспалительные факторы роста, а также факторы роста, стимулирующие образование новых кровеносных сосудов, например ангиогенин (ANG), фактор роста эндотелия сосудов (VEGF) и другие.
«Первый шаг с любым трансплантатом — снижение иммунитета реципиента, чтобы ограничить риск отторжения, — говорит руководитель работы Екатерина Беришвили (Женевский университет, Государственный университет Ильи в Тбилиси). — Амниотические эпителиальные клетки обладают уникальной характеристикой защиты плода, который также «не-свой», от атак иммунной системы его матери. Мы полагаем, что тот же механизм работает для защиты трансплантатов».
Для получения многоклеточных органоидов для трансплантации (исследователи назвали эти органоиды «суперостровками Лангерганса»), бета-клетки и КАЭ сначала растили как отдельные клеточные культуры, затем смешивали их и культивировали в микроплашке на агарозном 3D-матриксе.
Oрганоиды хорошо приживались после трансплантации и продуцировали больше инсулина по сравнению с бета-клетками, пересаженными по старой методике. Для сравнения уровней мРНК инсулина в культивируемых бета-клетках и в смешанной культуре КАЭ и бета-клеток использовали количественную ПЦР в реальном времени с обратной транскрипцией. Также ученые измеряли продукцию инсулина в ответ на стимуляцию глюкозой и обнаружили, что органоиды из двух типов клеток продуцируют больше инсулина, нежели монокультура бета-клеток. В ответ на гипоксию в органоидах нового типа значительно сильнее возрастал уровень транскрипционного фактора HIF-1α, регулирующего клеточный ответ на гипоксию (см. о нем в рассказе о Нобелевской премии по физиологии или медицине 2019 года) и в меньшей степени активировались каспазы апоптотического пути клеточной гибели.
Наконец, органоиды трансплантировали мышам с диабетом. Через месяц после трансплантации нормогликемия восстановилась у 96% мышей в группе, получившей органоиды из бета-клеток и КАЭ, и всего у 16% мышей, которым имплантировали монокультуру бета-клеток.
Следующим шагом должна быть проверка этого метода на людях и, если эффективность метода подтвердится в клинических испытаниях — внедрение в медицинскую практику.
Источники
F. Lebreton et al // Insulin-producing organoids engineered from islet and amniotic epithelial cells to treat diabetes. // Nature Communications, 2019, 10, 4491; DOI: 10.1038/s41467-019-12472-3
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0