Ученые превратили микроглию в нейроны, чтобы восстановить мозг мышей после инсульта
Способность нейронов к регенерации ограничена, поэтому последствия инсульта часто необратимы. Ученые из Японии и Германии восстановили поврежденный ишемией мозг модельных мышей, перепрограммировав клетки микроглии в нейроны с помощью фактора транскрипции NeuroD1. Это позволило заместить погибшие нейроны и восстановило двигательную активность животных, которая нарушилась после инсульта.
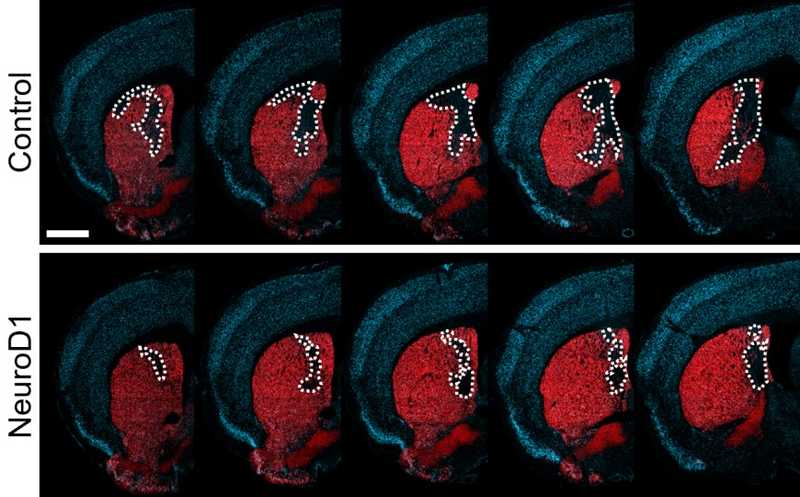
Экспрессия NeuroD1 в клетках микроглии индуцирует их превращение в нейроны, которые восстанавливают поврежденный инсультом участок стриатума (на изображении окрашен красным).
Credit:
Irie et al. PNAS 2023 |
пресс-релиз
При инсульте, а также некоторых других цереброваскулярных заболеваниях, нарушающих кровоснабжение головного мозга, повреждаются нейроны. Следствием этого могут быть когнитивные нарушения, также инсульт нередко приводит к инвалидности. Одна из стратегий восстановления нейронов в очаге повреждения — это превращение в них других клеток мозга. Авторы публикации в PNAS предложили использовать для этой цели микроглию — иммунные клетки центральной нервной системы.
Клетки микроглии — резидентные макрофаги ЦНС — удаляют поврежденные или мертвые клетки мозга, поэтому после инсульта они перемещаются к очагу повреждения, где активно размножаются. Кроме того, при нарушении гематоэнцефалического барьера при инсульте в мозг проникают и периферические макрофаги, которые со временем меняют профиль экспрессии и становятся похожими на микроглию.
Инсульт авторы работы моделировали на мышах, проводя 30-минутную окклюзию средней мозговой артерии (MCAO). Сперва они охарактеризовали повреждения мозга после временной ишемии — очаг поражения в основном ограничивался стриатумом, и в дальнейшем анализе ученые сосредоточились именно на нем. Они исследовали пространственно-временное распределение микроглии и макрофагов в стриатуме после MCAO. Иммуногистохимический анализ проводили с окрашиванием на микроглиальный маркер Tmem119 (он также экспрессируется в микроглиеподобных клетках, полученных из периферических макрофагов, но не в самих периферических макрофагах). На третий день после ишемии в поврежденном стриатуме присутствовало немного микроглиальных клеток, однако их число резко увеличилось к седьмому дню и сохранялось к десятому.
Предыдущие исследования этого же коллектива показали, что транскрипционный фактор NeuroD1 (ND1) способен напрямую превращать микроглию в нейроны. Это происходило как in vitro, так и в мозге взрослых мышей. Опираясь на эти данные, ученые решили проверить, будет ли такое превращение происходить и в очаге инсульта. Для доставки ND1 они использовали лентивирусный вектор, кодирующий этот белок под промотором CD68 (этот ген в норме экспрессируется в клетках микроглии, а после инсульта его экспрессия возрастает). Лентивирус вводили в ишемизированную область через неделю после MCAO, к моменту, когда микроглиальные клетки скопятся в достаточном количестве. Трансдукцию подтверждали по флуоресценции репортерного GFP — ее эффективность составила около 80%. Спустя две недели после инъекции вируса очень немногие трансдуцированные клетки сохраняли микроглиальный профиль — это говорит о том, что к этому моменту они уже начали перепрограммироваться в нейроны. Это подтверждается и другими окрашиваниями — около 60% ND1-трансдуцированных клеток экспрессировали βIII-тубулин, и около 30% — Map2ab. Таким образом, за две недели микроглия, в которой экспрессировали ND1, как минимум частично превратилась в нейроны в поврежденном стриатуме.
Исследователи также убедились, что индуцированные нейроны происходили именно из микроглии, а не из нейрональных клеток-предшественников, способных мигрировать в очаг повреждения. Они проверили это с помощью флуоресцентных меток — в нейрональные клетки-предшественники внедрили ген, кодирующий tdTomato, чтобы окрасить как их, так и происходящие от них клетки. Флуоресценции tdTomato в индуцированных нейронах не наблюдалось, зато они экспрессировали GFP, полученный ими от микроглиальных клеток — это подтверждает их происхождение из микроглии.
Дальнейшее исследование показало, что индуцированные клетки приобрели свойства проекционных нейронов стриатума (SPN, striatal projection neurons). Они экспрессировали DARPP32 и Ctip2 (последний контролирует созревание и выживание SPN), но не Cux1 (маркер нейронов коры) или кальретинин (маркер интернейронов).
Кроме того, поведение индуцированных нейронов соответствовало типичным SPN и с точки зрения электрофизиологии. На четвертую неделю после трансдукции авторы работы регистрировали их активность методом пэтч-кламп и наблюдали потенциал действия в ответ на деполяризацию. Кроме того, индуцированным нейронам, как и типичным SPN, оказалась свойственна длительная задержка перед генерацией потенциала действия. У контрольной трансдуцированной микроглии электрический ответ отсутствовал. Исследователи также детектировали в индуцированных нейронах спонтанную синаптическую активность — как возбуждающую, так и тормозную, — чего не происходило в контрольной микроглии. Таким образом, экспрессия ND1 превращала микроглиальные клетки в функциональные нейроны, хотя некоторые из них могли еще не полностью созреть за четыре недели, о чем говорят незначительные отличия в электрофизиологических свойствах.
Анатомически нейроны, полученные из микроглии, также встраиваются в структуру мозга подобно SPN. Известно, что в стриатум направляются проекции от дофаминергических нейронов, расположенных в черной субстанции. С помощью окрашивания на тирозингидроксилазу (TH) — фермент синтеза дофамина — авторы исследования показали, что почти все тела индуцированных ND1 нейронов контактировали с проекциями дофаминергических нейронов. Сами же индуцированные нейроны посылали проекции в бледный шар аналогично тому, как это делают SPN — ученые установили это с помощью анализа ретроградного транспорта.
Наконец, исследователи продемонстрировали, что формирование нейронов из микроглии в очаге повреждения восстанавливает двигательную активность мышей, нарушенную после инсульта. Различные тесты на моторную активность показали, что движения мышей, перенесших MCAO, были асимметричны. Начиная с трех недель после инъекции вирусного вектора с ND1 состояние животных улучшалось. Ученые подтвердили, что восстановление двигательной активности обеспечивается именно индуцированными нейронами. Для этого они провели опыты на трансгенных мышах, в клетках которых экспрессируется рецептор дифтерийного токсина. После MCAO им вводили в стриатум вирус, кодирующий ND1 и Cre-рекомбиназу под специфичным для микроглии промотором CD68. Инъекция дифтерийного токсина таким животным резко сокращала количество индуцированных нейронов, и функционального восстановления при этом практически не наблюдалось. Это подтверждает роль полученных из микроглии нейронов в восстановлении моторной активности мышей после MCAO.
«Полученные результаты весьма многообещающи, — комментирует профессор Киничи Накасима, руководитель исследования. — Следующий шаг — проверить, будет ли NeuroD1 эффективен и для превращения человеческой микроглии в нейроны, а также подтвердить, что наш метод внедрения генов в микроглиальные клетки безопасен».
Цитата по пресс-релизу
Особый вид Т-клеток участвует в восстановлении мозга после инсульта
Источник
Takashi Irie et al. Direct neuronal conversion of microglia/macrophages reinstates neurological function after stroke. // PNAS, October 10, 2023. DOI: 10.1073/pnas.2307972120


 Меню
Меню





 Все темы
Все темы




 0
0