В Китае получены химерные макаки, экспрессирующие GFP
Китайские исследователи получили химерных макак-крабоедов. Сначала они создали несколько линий эмбриональных стволовых клеток, которые экспрессировали зеленый флуоресцентный белок GFP, а потом ввели их в эмбрионы генетически отличных особей. У некоторых детенышей доля донорских клеток в различных тканях составляла десятки процентов. Этот результат важен для развития генной инженерии приматов.
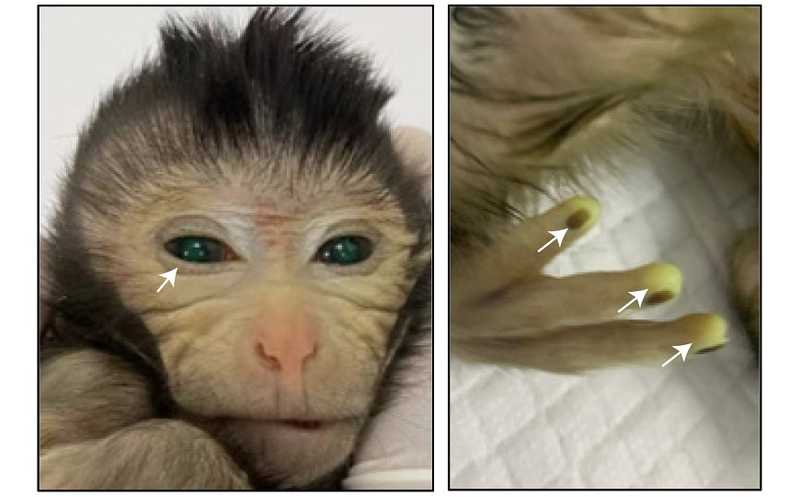
В Cell опубликована статья китайских ученых, которые получили клетки макаки-крабоеда, экспрессирующие зеленый флуоресцентный белок GFP, а затем химерные эмбрионы, содержащие такие клетки. Эмбрионы были имплантированы суррогатным матерям, и в итоге удалось получить не только плоды на поздних стадиях развития, но и живорожденных химерных детенышей.
Это исследование имеет большое значение для изучения механизмов плюрипотентности. Клетки из внутренней части бластоцисты млекопитающих обладают плюрипотентностью, и это свойство удается воспроизвести при культивировании эмбриональных стволовых клеток (ЭСК) или получении индуцированных плюрипотентных стволовых клеток (иПСК). Чтобы продемонстрировать, что плюрипотентные стволовые клетки млекопитающих, полученные из различных источников, эквивалентны эмбриональным клеткам, существует классический способ: получение химерных эмбрионов, в которых часть клеток замещена ПСК. Подобные эксперимент проводились на грызунах, однако опыты на приматах были не слишком успешными.
Кроме того, исследователям нужны модели для изучения генных модификаций приматов. Альтернативой редактированию эмбрионов с помощью CRISPR-Cas может быть получение химер, однако в предыдущих опытах на макаках-крабоедах доля генетически отличных донорских клеток в тканях химеры была крайне низкой (0,1–4,5%). Очевидно, это происходит из-за рассогласования траекторий развития, которое ведет к конкурентной элиминации донорских клеток. Предотвратить их апоптоз можно с помощью сверхэкспрессии некоторых факторов (BCL2 и BMI1), что позволяет получать даже межвидовые химеры, но повышает риск возникновения геномных аномалий. Более перспективной представляется оптимизация протоколов культивирования с тем, чтобы получить плюрипотентные клетки, более сходные с клетками эмбриона.
Недавно описанная теми же авторами среда 4CL позволяет выращивать стволовые клетки человека с высокими уровнями экспрессии генов плюрипотентности, в которых даже при длительном культивировании не возникают аномальные кариотипы. В новой работе исследователи протестировали различные среды для выращивания человеческих ПСК (RSeT, 5iLAF, PXGL и 4CL), чтобы оптимизировать получение химерных обезьян. Также они детально разработали методы исследования химер: подсчет клеток, экспрессирующих GFP, анализ SNP в ядерной и митохондриальной ДНК и транскриптомное профилирование единичных клеток.
Эмбриональные стволовые клетки макак, выращенные на 4CL, демонстрировали наиболее сбалансированное сочетание деметилирования ДНК и экспрессии генов плюрипотентности, а также наибольшую геномную стабильность. Клетки, помеченные GFP, вводили в эмбрионы на стадии морулы (около 15 клеток на каждый эмбрион). Наилучшая выживаемость донорских клеток при нормальном развитии бластоцисты наблюдалась при культивировании в течение 72 часов на смеси сред 4CL и HECM9 в соотношении 1:1. Наивные (полученные из эмбрионов до имплантации) ЭСК обезьян более успешно образовывали химеры, чем праймированные (из постимплантационных эмбрионов).
При длительном культивировании (до 17 дня после оплодотворения) доля клеток, экспрессирующих GFP, оставалось значительной. Авторы проанализировали экспрессию генов GFP-положительных клеток в химерных эмбрионах и убедились, что они кластеризуются с клетками природных и культивируемых in vitro эмбрионов.
Затем были созданы 206 химерных эмбрионов на стадии морулы, из них получили 91 бластоцисту, и 74 бластоцисты с хорошим GFP сигналом были пересажены 40 суррогатным матерям, у 12 из которых наступила беременность. В итоге удалось получить 4 абортированных плода и 6 живорожденных детенышей. ПЦР-анализ подтвердил присутствие гена GFP у двух из плодов; тем не менее абортированы были даже зародыши, не имеющие этого гена, — возможно, апоптоз донорских клеток снизил их жизнеспособность.
Сильная экспрессия GFP наблюдалась у детеныша под номером 10 во всем теле, особенно на кончиках пальцев, в хвосте и глазах. STR-анализ подтвердил, что он является химерой. Однако через десять дней у этого детеныша начались дыхательная недостаточность и гипотермия, и его пришлось усыпить.
Ткани двух химерных обезьянок были детально исследованы. Чтобы количественно оценить вклад донорских клеток в разные ткани, в митохондриальной ДНК и геномной ДНК идентифицировали SNP, различавшиеся у донора и эмбриона-хозяина. У детеныша №10 вклад, оцененный по трем SNP в мтДНК, варьировал в 26 тканях от 21% до 92% со средним значением 67%, а исследование трех SNP в Х-хромосоме дало средний вклад 63%. У абортированного зародыша вклады были существенно меньше (15% и 18% соответственно). В клетках костного мозга и периферической крови доля донорских клеток, оцененная по визуализации флуоресценции GFP, у детеныша №10 достигла 88% и 78% соответственно, в клетках костного мозга абортированного плода — 20%. Для будущих генноинженерных исследований особенно важно, что донорские клетки присутствовали и в тканях семенников и плаценты. Транскриптомный анализ подтвердил, что клетки функционально включены в организм химерных животных.
Авторы отметили повышенный уровень метилирования ДНК в GFP-положительных клетках по сравнению с GFP-отрицательными. Существенных отличий в экспрессии генов или геномном импринтинге не наблюдалось, тем не менее авторы считают возможным, что причиной выкидышей и плохого здоровья новорожденных может быть дифференциальное метилирование клеток разного происхождения.
Эти результаты имеют большое значение для исследования плюрипотентности и генной инженерии приматов. Предложенный подход позволит создавать модельных обезьян со сложными модификациями генов, включая вставки и замены крупных фрагментов для фундаментальных и трансляционных исследований.
Источник
Jing Cao, et al. Live Birth of Chimeric Monkey with High Contribution from Embryonic Stem Cells // Cell. 2023. DOI: 10.1016/j.cell.2023.10.005


 Меню
Меню





 Все темы
Все темы




 0
0








