В развитие болезни Паркинсона вносит вклад эпигенетика
Исследователи показали, что болезнь Паркинсона сопровождается изменением метилирования и гидроксиметилирования энхансеров — регуляторных участков генов в нейронах префронтальной коры. Ключевую роль в этих изменениях играет ген TET2, активность которого повышена при болезни Паркинсона. Снижение уровня продукта этого гена может стать новым путем терапии заболевания.
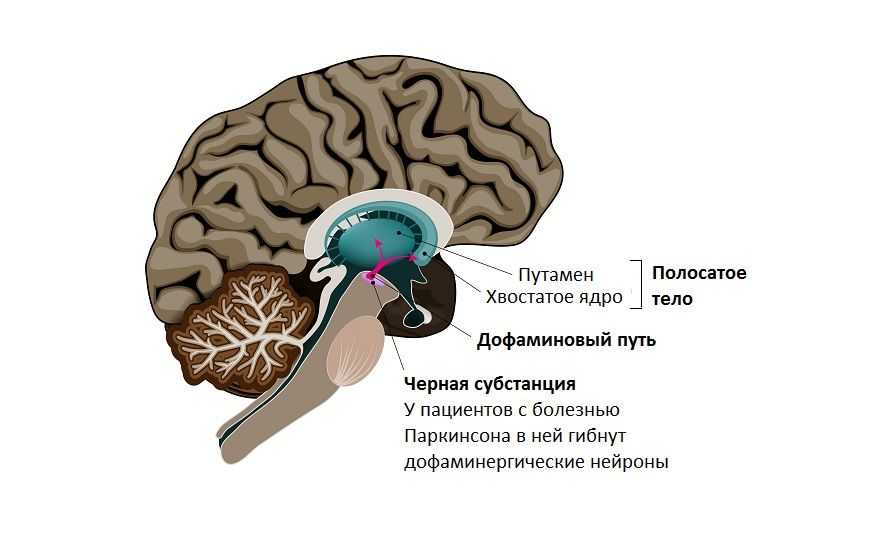
Болезнь Паркинсона — нейродегенеративное заболевание, основными симптомами которого служат двигательные нарушения и тремор. Основная мишень болезни — черная субстанция мозга, в ней гибнут дофаминергические нейроны. В патогенезе болезни участвует также префронтальная кора, нейроны которой, в основном глутаматергические и ГАМК-эргические, не гибнут, но изменяются. Есть предположение, что эти изменения начинаются с эпигенетических модификаций нейронов.
Это предположение проверили специалисты из Института Ван Энджел (штат Мичиган, США) и Мичиганского университета при участии коллег из других университетов США и Литвы. Они исследовали эпигенетические модификации нейронов префронтальной коры из взятого посмертно материала у 57 пациентов, страдавших болезнью Паркинсона (БП) и 48 контрольных индивидов. Предметом анализа послужили энхансеры — участки ДНК, которые стимулируют активность генов, действуя на промоторы, причем энхансеры, в отличие от промоторов, находятся не рядом с целевым геном. Они сближаются с промоторами посредством петли, образующейся при трехмерной укладке хроматина. В работе проанализированы 31 с половиной тысяч энхансеров.
Методом бисульфитного секвенирования исследовали эпигенетические модификации цитозина в энхансерах и нашли 1799 сайтов, которые у пациентов с БП и контрольных индивидов были метилированы по-разному; в большинстве случаев в группе БП они были гиперметилированы
На следующем этапе ученые занялись поиском целевых генов, которые меняют свою активность посредством эпигенетически модифицированных энхансеров. Нашли 536 таких генов, которые участвуют в биохимических путях, вовлеченных в нейрогенез, развитие нейронов и структуры синапсов. Многие из них, как было показано ранее, имеют отношение к механизму развития нейродегенеративных заболеваний.
Наибольший интерес у исследователей вызвал ген TET2 — ключевой регулятор эпигенетических модификаций ДНК. Фермент ТЕТ2 отвечает не только за метилирование, но и за гидроксиметилирование, которое имеет обратный эффект. Если метилирование энхансеров по цитозиновым сайтам ведет к подавлению функции гена, то гидроксиметилирование активирует транскрипцию и усиливает работу энхансеров. Ученые обнаружили, что у пациентов с БП в нейронах префронтальной коры уровень гидроксиметилирования энхансеров повышен. Ранее было показано, что гидроксиметилирование усиливается в стареющем мозге и при нейродегенеративных заболеваниях, а также при воспалительных процессах.
В группе пациентов с БП была повышена и экспрессия самого гена TET2. Исследователи предположили, что именно его избыточная активность изменяет состояние энхансеров других генов. На клеточной модели они подтвердили, что снижение экспрессии TET2 значительно снижало модификацию энхансеров. Затем обратились к мышам, и на мышиной модели показали, что инактивация ТЕТ2 защищает от вызванной воспалением потери дофаминергических нейронов в черной субстанции.
Таким образом, помимо демонстрации роли эпигенетических модификаций нейронов в патогенезе БП, авторы предложили и возможный путь терапии заболевания — снижение уровня фермента ТЕТ2 в мозге.
Источник
Lee L. Marshall et al. // Epigenomic analysis of Parkinson’s disease neurons identifies Tet2 loss as neuroprotective // Nature Neuroscience. 2020 Aug 17, DOI: 10.1038/s41593-020-0690-y


 Меню
Меню





 Все темы
Все темы




 0
0








