В развитии болезни Баттена участвует регуляторный лизосомный белок CLN3
Болезнь Баттена связана с мутациями в гене CLN3. Ученые из США и Италии обнаружили, что CLN3 служит связующим звеном между M6PR-зависимым транспортом лизосомных ферментов и процессом реформирования лизосом. Это объясняет, как нарушения в работе CLN3 препятствуют нормальному функционированию лизосом и могут становиться причиной развития заболевания.
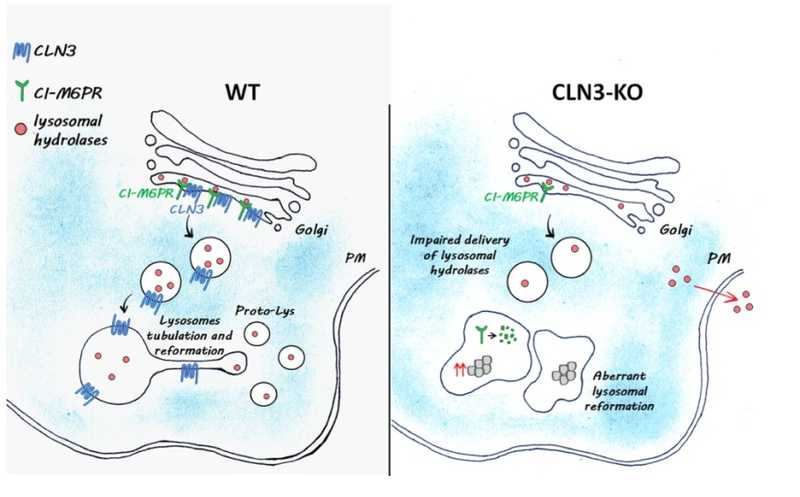
Модель роли CLN3 в регуляции биогенеза и реформации лизосом: в норме лизосомальные ферменты распознаются CI-M6PR и транспортируются в лизосомы. Отсутствие CLN3 нарушает этот процесс и препятствует сортировке неосинтезированных лизосомальных ферментов. Это снижает их уровень внутри лизосом и, как следствие, приводит к нарушению их биогенеза и накоплению липофусцинов.
Credit:
Nature Communications (2023). DOI:
10.1038/s41467-023-39643-7 |
CC BY
Нейрональные цероидные липофусцинозы (NCL) представляют собой нейродегенеративные лизосомные болезни накопления (LSD), связанные с неконтролируемым увеличением количества липофусцина внутри лизосом. Они возникают в результате мутаций в генах, кодирующих либо трансмембранные (CLN3, CLN7), либо растворимые (CLN1, CLN2, CLN5) лизосомальные белки, а также нелизосомальные белки (CLN6, CLN8). Биохимическая функция и физиологическая роль большинства CLN белков остается не до конца изученной.
CLN3 — трансмембранный белок, который, по-видимому, локализован преимущественно в лизосомах. Его мутации лежат в основе развития болезни Баттена. Это заболевание связано с накоплением липофусцина преимущественно в головном мозге. Среди его симптомов — слепота, судороги и деменция, а также прогрессирующие нарушения когнитивных и двигательных навыков, в конечном счете приводящие к летальному исходу. Одобренные в настоящее время методы лечения болезни Баттена направлены только на симптомы заболевания, а эффективные терапевтические подходы недоступны из-за отсутствия знаний о биологической функции CLN3. Ученые из Техасской детской больницы совместно с Институтом генетики и медицины в Италии решили исследовать роль белка CLN3 в функционировании лизосом.
Для изучения субклеточной локализации CLN3 авторы разработали новое поликлональное антитело, специфичное к этому белку. При помощи микроскопии сверхвысокого разрешения они определяли, в каких компартментах располагается эндогенный CLN. Эти данные подтверждали с использованием доксициклин-индуцируемой CLN3 конструкции с внутренней меткой (CLN3-innHA). Оказалось, что белок располагался преимущественно в аппарате Гольджи и в лизосомных компартментах.
С помощью иммуноблота, иммуноочистки лизосом и доксициклин индуцируемой CLN3 конструкции авторы установили наличие в клетках двух форм белка CLN3: весом 45 кДа и 65–80 кДа, которые представляют собой вновь синтезированную и зрелую форму белка соответственно. Последняя подвергается сильному гликозилированию при транспортировке через аппарат Гольджи и лизосомные компартменты.
Затем ученые охарактеризовали белок-белковые взаимодействия в клетках CLN3-innHA с помощью коиммунопреципитации и масс-спектрометрии. Анализ интерактома показал, что CLN3 взаимодействует с несколькими белками и белковыми комплексами, участвующими в различных путях транспорта эндолизосом, и с катион-независимым маннозо-6-фосфатным рецептором (CI-M6PR). Этот рецептор отвечает за перенос лизосомных ферментов непосредственно в лизосомы. Также было отмечено, что количество взаимодействий CLN3 с другими белками возрастало при длительном голодании клеток.
Дальнейший анализ интерактома показал, что наибольшее число взаимодействий происходит между CLN3 и CI-M6PR. При этом уровень CI-M6PR в клетках значительно снижался в отсутствие CLN3.
Анализ протеома лизосомальной фракции клеток дикого типа и клеток с нокаутированным CLN3 подтвердил снижение уровня CI-M6PR. Также он показал, что в отсутствие CLN3 уменьшалась экспрессия 14-ти разнообразных лизосомных гидролаз. Эти результаты, подтвержденные иммуноблотом и анализом ферментов, свидетельствуют о нарушениях в сортировке лизосомных ферментов при отсутствии белка CLN3.
Ультраструктурный анализ клеток с нокаутированным CLN3 выявил наличие увеличенных и агрегированных лизосом и накопление аутолизосом. Это свидетельствует о нарушении аутофагального реформирования лизосом ─ процесса, необходимого для образования новых функционирующих протолизосом из зрелых лизосом. Из этого следует также нарушение аутофагии в таких клетках.
Оверэкспрессия CLN3, наоборот, способствовала формированию множественных небольших лизосом и повышению уровня лизосомальных ферментов, а также стимулировала зависимое от аутофагии формирование новых лизосом.
Таким образом, ученые выяснили, что CLN3 играет решающую роль в биогенезе лизосом и аутофагальном реформировании лизосом, и охарактеризовали механизм развития болезни Баттена.
Источник
Calcagni’ A., et al. Loss of the batten disease protein CLN3 leads to mis-trafficking of M6PR and defective autophagic-lysosomal reformation // Nature Communications (2023). DOI: https://doi.org/10.1038/s41467-023-39643-7


 Меню
Меню





 Все темы
Все темы




 0
0