Воздействие на метаболизм T-клеток повышает эффективность анти-PD-1 иммунотерапии
Ингибиторы контрольных точек иммунного ответа не всегда подавляют развитие онкозаболеваний. Причина может заключаться в разной восприимчивости популяций T-клеток к, например, анти-PD-1 терапии. Авторы статьи в Nature Immunology показали, что нокаут пируваткиназы M2 в T-клетках активирует пентозофосфатный путь и подавляет гликолиз, что придает им некоторые свойства клеток-предшественников. Такие клетки особо чувствительны к ингибированию PD-1. Воздействие на метаболизм T-клеток одновременно с анти-PD-1 терапией повысило выживаемость мышей с опухолями.
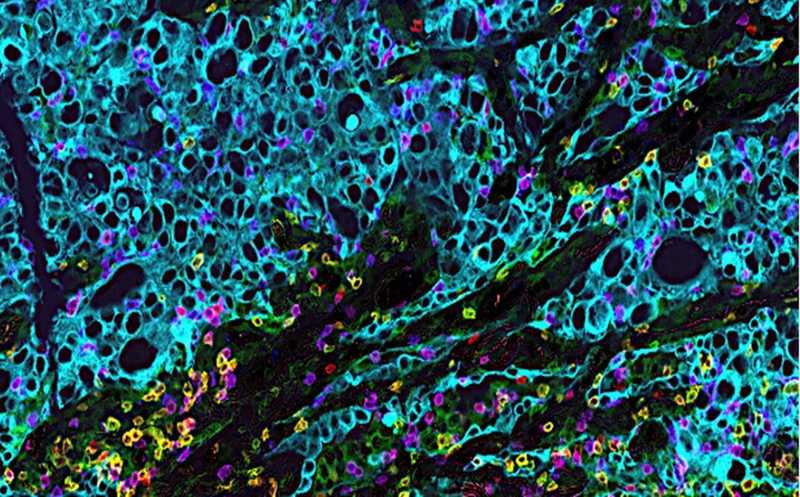
Аденокарцинома легкого и микроокружение опухоли с T-клетками. Голубым обозначены раковые клетки. T-клетки: CD3 (красный), CD4 (зеленый), CD8 (разовый), FoxP3, маркер регуляторных клеток (желтый).
Credit:
Mittal lab |
Пресс-релиз
CD8+ T-клетки и другие иммунные клетки помогают бороться с опухолями. Но со временем они истощаются и начинают экспрессировать такие белки, как PD-1. Этот механизм, по-видимому, в норме сдерживает иммунный ответ. Иммунотерапия ингибиторами контрольных точек иммунитета (например, анти-PD-1) очень эффективна для некоторых пациентов, но не для всех. Возможно, дело в разной чувствительности различных популяций T-клеток.
Истощенные предшественники CD8+ T-клеток — клетки в микроокружении опухоли, похожие по свойствам на клетки памяти, обеспечивающие более длительный противоопухолевый иммунный ответ, чем эффекторные клетки. Маркером таких T-клеток является фактор транскрипции TCF1 (в эффекторных T-клетках TCF1 не экспрессируется). Есть данные, что истощенные предшественники CD8+ T-клеток — основная популяция клеток, отвечающих на анти-PD-1 терапию. Различное влияние препарата на популяции клеток может быть обусловлено отличиями в их метаболизме. Более того, появляется все больше данных об эффективности препаратов, затрагивающих метаболические пути, при злокачественных новообразованиях. Авторы статьи в Nature Immunology проанализировали особенности метаболизма опухоль-инфильтрирующих CD8+ T-клеток, а также исследовали влияние их метаболизма на эффективность анти-PD-1 терапии.
Авторы секвенировали РНК, чтобы исследовать транскриптом опухоль-инфильтрирующих лимфоцитов (TIL), полученных от мышиной модели немелкоклеточного рака легких (НМРЛ). Они добавили к этим данным ранее полученные результаты исследований транскриптома мелких (отвечающих на терапию анти-PD-1) и крупных (не отвечающих на терапию анти-PD-1) опухолей и провели анализ обогащения набора генов (GSEA). Оказалось, что в CD8+ T-лимфоцитах крупных опухолей в сравнении с лимфоцитами мелких опухолей повышена экспрессия ферментов гликолиза, что указывает на активный, но неэффективный ответ.
Исследователи совместно культивировали опухолевые клетки, экспрессирующие белок OVA (овальбумин, альбумин яичного белка), и OT-I клетки (CD8+ Т-клетки, распознающие белок OVA). Используя малые шпилечные РНК, ученые провели скрининг и обнаружили, что нокаут большинства генов гликолиза приводит к гипофункции лимфоцитов. Однако нокаут гена PKM (пируваткиназы M) повысил экспресcию TCF1 и SlamF6 (маркеров клеток-предшественников).
Различают две изоформы пируваткиназы M — PKM1 и PKM2. Анализ экспрессии обеих изоформ PKM в TIL из модели НМРЛ показал повышенную экспрессию преимущественно PKM2.
Нокаут PKM2 в ко-культивированных Т-клетках повышает экспрессию TCF1 и SlamF6 и снижает экспрессию GzmB, IFNγ и TNFα. Жизнеспособность клеток не снижалась, в отличие от способности к пролиферации. Аналогичные результаты были получены при переносе PKM2 KO T-клеток (Т-клеток с нокаутированным геном PKM2) облученным мышам модели НМРЛ. Таким образом, дефицит PKM2 способствует формированию фенотипа, присущего истощенным предшественникам T-клеток. Но это не влияет на рост опухоли или выживаемость мышей.
Существуют данные о положительной связи между количеством TCF1+ CD8+ T-клеток и эффективностью анти-PD-1 терапии, а дефицит PKM2 способствует увеличению количества TCF1+ CD8+ T-клеток. Мышам модели НМРЛ вводили PKM2 KO T-клетки или PKM2 WT T-клетки (экспрессирующие ген PKM2) и дополнительно давали анти-PD-1 терапию. Получившие PKM2 KO Т-клетки мыши показали лучшую выживаемость и более медленный рост опухоли в сравнении с получившими PKM2 WT T-клетки мышами.
Авторы проанализировали метаболиты в PKM2 KO и PKM2 WT T-клетках. В PKM2 KO T-клетках в сравнении с PKM2 WT T-клетками обнаружили большее количество метаболитов пентозофосфатного пути (ПФП) и сниженное количество промежуточных продуктов гликолиза. Таким образом, дефицит PKM2 изменяет метаболизм глюкозы и направляет его преимущественно по ПФП.
Глюкозо-6-фосфатдегидрогеназа (ГФДГ) — основной фермент ПФП. Т-клетки обработали агонистом ГФДГ, таким образом повысив активность ГФДГ и, следовательно, эффективность ПФП. В результате увеличилось число TCF1+ клеток и снизилась выработка IFNγ. То есть клетки приобретали свойства клеток-предшественников. Их пересадили мышам модели НМРЛ, которым затем давали анти-PD-1 терапию. Совместное использование агониста ГФДГ и анти-PD-1 терапии повысило выживаемость мышей. Эффективность комбинации также была показана на органоидах, полученных из человеческих клеток.
По мнению авторов, воздействие на метаболические пути совместно с иммунотерапией — перспективное и многообещающее направление исследований, которое может привести к повышению эффективности лечения злокачественных новообразований.
Кетогенная диета и ингибирование пути MNK–P-eIF4E тормозят рост опухоли
Источник:
Markowitz G.J., et al. Deficiency of metabolic regulator PKM2 activates the pentose phosphate pathway and generates TCF1+ progenitor CD8+ T cells to improve immunotherapy. // Nature Immunology 25, 1884–1899 (2024), published online 26 September 2024. DOI: 10.1038/s41590-024-01963-1


 Меню
Меню





 Все темы
Все темы




 0
0