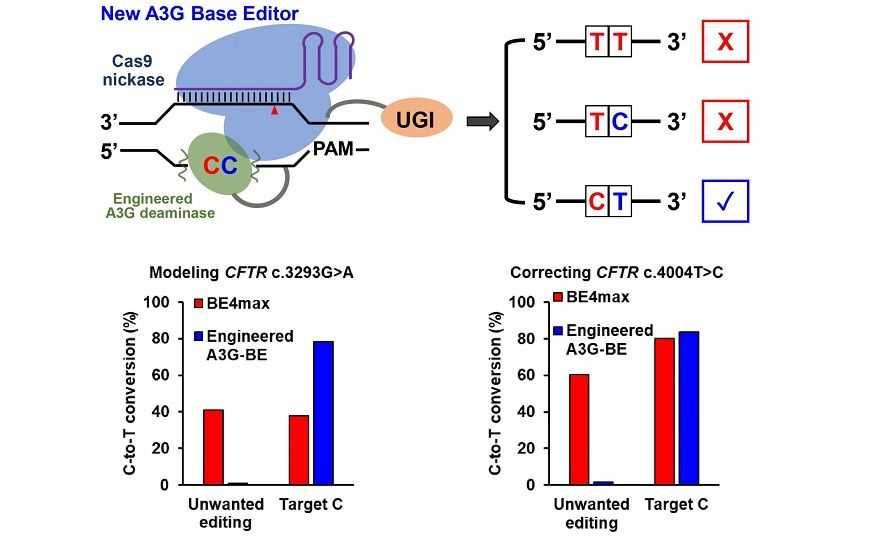
Высокоточный редактор оснований ДНК сконструирован для замены одного C в CC-мотивах
Исследователи из США и Китая заявили о создании редактора цитозина на основе дезаминазы APOBEC3G и никазы Cas9. Новый редактор оснований отличается повышенной точностью и способен различать два цитозина в мотиве 5’-CC-3’, модифицируя только второй из них.
Credit: Gao Lab/Rice University | Пресс-релиз
Редакторы цитозина, созданные путем слияния дезаминазы с никазой Cas9, считаются более точным инструментом для устранения точечных мутаций, чем программируемое редактирование генома с помощью введения двуцепочечных разрывов при помощи Cas9 и последующей репарации. Однако все редакторы такого рода имеют общий существенный недостаток: они модифицируют все остатки цитозина, которые находятся в зоне их действия, а не только один остаток, который требуется. Особенно сложны для изменения с помощью редактора цитозиновых оснований последовательности, в которых таргетный цитозин соседствует с другим цитозином (5’-CC-3’) — все существующие редакторы цитозиновых оснований превратят в тимин оба. В то же время, около 38% патогенных однонуклеотидных полиморфизмов человека связаны с заменой T на C (в результате замены получается последовательность CC), поэтому создание высокоточных редакторов цитозиновых оснований необходимо.
В статье, опубликованной в Science Advances, сообщается о создании нового высокоточного редактора цитозиновых оснований, который даже в последовательности 5’-CC-3’ модифицирует не оба цитозина, а лишь тот, который расположен ближе к 3’-концу. Точность редактора повышена за счет использования дезаминазы APOBEC3G.
Дезаминазы группы APOBEC в природе имеются у позвоночных и обеспечивают защиту от ретровирусов и ретротранспозонов, дезаминируя цитозин до урацила в вирусной комплементарной ДНК. В предыдущих исследованиях было показано, что APOBEC3G преимущественно распознает третий цитозин в мотиве 5’-CCСА-3’. Авторы новой работы сначала убедились в том, что дезаминаза сохраняет это свойство при слиянии с никазой Cas9 (такой редактор оснований получил название A3G-BE), а затем изучили разнообразные варианты A3G-BE и дополнительно улучшили их каталитическую активность и растворимость с помощью мутагенеза. В результате было получено три варианта редакторов оснований, которые демонстрируют высокую точность при редактировании цитозина в контексте CC.
Эффективность вариантов фермента оценивалась на клетках линии HEK293. Авторы продемонстрировали их действенность в редактировании некоторых патогенных однонуклеотидных полиморфизмов. Чтобы оценить частоту событий нецелевого редактирования на уровне всего генома, исследователи провели полногеномное секвенирование клеток. Кроме того, с помощью секвенирования РНК они оценили вклад A3G-BE в модификацию клеточных РНК. Авторы заявляют, что частота побочных эффектов A3G-BE на геномном и транскриптомном уровне настолько низка, что фермент можно рассматривать как потенциальный инструмент для терапевтического редактирования генома.
Источник
Sangsin Lee, et al. // Single C-to-T substitution using engineered APOBEC3G-nCas9 base editors with minimum genome- and transcriptome-wide off-target effects. // Science Advances, Vol. 6, no. 29, eaba1773; DOI: 10.1126/sciadv.aba1773


 Меню
Меню





 Все темы
Все темы



 0
0