Мышиные модели иммунодефицита: как и зачем
На мышах с иммунодефицитом изучают онкозаболевания, стволовые клетки, работу иммунной системы и различные инфекции, вплоть до ВИЧ. Их разновидности используют в науке более 60 лет, и по мере появления новых линий иммунодефицит становился все более выраженным, а спектр применения — все более широким. Разбираемся, как и когда появились мышиные модели иммунодефицита, чем они отличаются и как работают.
Многие исследования заболеваний человека были бы невозможны без иммунодефицитных модельных животных, и среди них больше всего мышей, как и в целом среди лабораторных животных. Активность собственного иммунитета мыши помешала бы успешной ксенотрансплантации человеческих клеток или тканей — популярному подходу к изучению, например, рака. Кроме того, нарушения работы «родной» иммунной системы позволяют получить гуманизированных животных и оценить свойственные человеку реакции иммунитета в их организме или изучить на них инфекцию человеческими патогенами.
В настоящее время существует ряд линий мышей с иммунодефицитом, которые отличаются генетически — закрепленные у них мутации определяют разные механизмы нарушения работы иммунной системы. Перечислим несколько самых распространенных.
Голые мыши
Самая ранняя мышиная модель иммунодефицита — голая мышь — описана в 1962 году Норманом Гристом в вирусологической лаборатории при больнице Рухилл (Шотландия). Эти мыши несут мутации в гене Foxn1, который экспрессируется в эпителии тимуса и кожи, регулируя баланс между ростом и дифференцировкой клеток. В его отсутствие нарушается дифференцировка нормальной ткани тимуса, и созревание Т-клеток в нем становится невозможным. Этот же ген необходим для нормального развития волосяного покрова, поэтому мыши с дефицитом Foxn1 лишены шерсти. Такая особенность этой породы по-своему удобна — пересаженные под кожу опухоли легко наблюдать и измерять.
 Credit:
Credit:Павел Русанов
Из-за того, что у голых мышей практически отсутствуют T-клетки, у них не возникает реакция отторжения при аллогенной трансплантации. B-клетки и NK-клетки, однако, у них сохраняются, и это затрудняет приживление иммунных клеток человека в организме таких животных. Из-за появления более перспективных моделей голые мыши сейчас теряют популярность, однако все еще широко применяются для изучения иммунных заболеваний и онкологии.
Тяжелый комбинированный иммунодефицит
 Credit:
Credit:123rf.com
Еще одна распространенная модель — это мыши с тяжелым комбинированным иммунодефицитом (SCID), который развивается из-за мутации в гене Prkdc. У людей тоже встречается врожденный иммунодефицит, связанный с мутацией именно в этом гене, однако такие случае крайне редки. Продукт экспрессии этого гена, ДНК-зависимая протеинкиназа, участвует в репарации двуцепочечных разрывов ДНК и поэтому играет важную роль в V(D)J-рекомбинации и, следовательно, дифференцировке B- и T-лимфоцитов. Зрелые B- и T- лимфоциты в организме SCID-мышей не формируются, что приводит к более выраженному иммунодефициту, чем у голых мышей. Однако у них все еще присутствуют NK-клетки и работает система комплемента. Для некоторых задач такого снижения работоспособности иммунитета все еще недостаточно.
Чтобы прийти к решению проблемы, нам нужно будет сделать шаг в сторону от собственно иммунодефицита и рассмотреть мышиные модели диабета, точнее, одну конкретную модель, созданную в начале 1980-х.
NOD-мыши
Мышиная модель диабета без ожирения (non-obese diabetic, NOD) была получена японскими учеными в 1980 году. Из-за полиморфизмов в генах Ctla-4 и Sirpα у NOD-мышей нарушен контроль иммунитета, что, с одной стороны, способствует аутоиммунному поражению поджелудочной железы и развитию диабета 1 типа, а с другой, несколько облегчает приживление ксенотрансплантатов. Кроме того, дефицит компонента системы комплемента C5 ослабляет врожденный иммунитет, подавляя хемотаксис провоспалительных миелоидных клеток и образование мембраноатакующего комплекса. Уровень NK-клеток в организме NOD-мышей также снижен.
Внесение в геном этих мышей мутации в гене Prkdc привело к появлению животных с более выраженным дефицитом, чем сама эта линия или SCID-мыши, — полученную мышиную модель обозначили как NOD/SCID. NOD/SCID мышей нарушен как врожденный, так и адаптивный иммунитет. Впервые полученная в 1995 году, эта мышиная модель характеризуется низким уровнем NK-клеток и их слабой активностью, подавленной работой системы комплемента и дефицитом интерлейкина-1 (IL-1). Такие особенности улучшили приживаемость человеческих трансплантатов у NOD/SCID мышей, однако они оказались чувствительны к облучению — дозы радиации при работе с ними необходимо сильно ограничивать.
NOD/SCID мыши служат популярной моделью в исследованиях онкозаболеваний еще и потому, что сами подвержены раку (в частности, лимфомам и опухолям тимуса). Кроме того, их часто используют в экспериментах с трансплантацией гемопоэтических стволовых клеток человека, необходимых для исследований ВИЧ или генной терапии.
Например, было показано, что именно на мышах NOD/SCID надежнее моделировать кишечно-ассоциированную лимфоидную ткань (GALT) человека благодаря формированию в организме этих мышей криптобляшек. (Криптобляшки — изолированные лимфоидные фолликулы, которые могут присутствовать в кишечнике наряду с Пейеровыми бляшками и участвуют в созревании γδ и αβ Т-лимфоцитов, не зависящем от тимуса.)
Нокаут Rag: отключение V(D)J-рекомбинации
Лишить мышь функциональных B- и T-клеток, как оказалось, можно и другим способом. В 1992 году вышло две публикации, описывающих мышей с нокаутом Rag-1 и Rag-2, соответственно. Обе исследовательские группы показали, что у нокаутных мышей нарушается формирование зрелых B- и T-лимфоцитов из-за того, что их клетки, как и клетки SCID-мышей, неспособны к V(D)J-рекомбинации — а без нее невозможно формирование антигенраспознающих участков Т-клеточных рецепторов и антител. Как и у SCID-мышей, активные NK-клетки у этой линии присутствуют, и в целом обе модели обладают похожими фенотипами. Однако, в отличие от SCID, Rag-дефицитные животные куда более устойчивы к радиации.
Выключение общей гамма-цепи рецепторов интерлейкинов — NSG и аналоги
Нуль-мутация в гене IL-2rγ (IL2rγnull) — общей цепи поверхностных рецепторов, передающих сигналы от шести различных интерлейкинов, — нарушает дифференцировку и работу многих гемопоэтических клеток. Мышей с такой мутацией получили в начале 2000-х годов, и вскоре начали применять ее в комбинации с NOD/SCID-моделью. Полученные NOD/SCID/gamma мыши, или NSG, считаются одними из наиболее иммунодефицитных в настоящее время, поскольку у них отсутствуют как зрелые B- и T-лимфоциты, так и NK-клетки, а также сильно нарушен цитокиновый сигналинг. В отличие от упомянутых выше NOD/SCID-мышей, NSG устойчивы к развитию лимфом. Кроме того, эта линия считается долгожителем среди иммунодефицитных мышей — продолжительность их жизни составляет в среднем 22 месяца. Мыши с тяжелым комбинированным иммунодефицитом живут около 8,5 месяцев (для сравнения — иммунокомпетентные мыши линии C57BL/6, на основе которой также можно получать различные модели отклонений работы иммунитета, живут в отсутствие патогенов до 20–30 месяцев).
 Иммунокомпетентные мыши линии C57BL/6.
Иммунокомпетентные мыши линии C57BL/6.Credit:
Павел Русанов
Существует и аналогичная мышиная модель — NOG, — в которой IL-2rγ не несет нуль-мутацию, а вместо этого кодирует белок, способный связывать интерлейкины, но не передавать сигнал.
Именно NOG и NSG мыши считаются наиболее перспективными для получения гуманизированных животных, поскольку в их организме хорошо приживаются и дифференцируются гемопоэтические стволовые клетки человека. К примеру, именно из NSG, которым дополнительно нарушили кроветворение с помощью мутации в гене Kit, получили гуманизированных мышей, достаточно адекватно моделирующих человеческую иммунную систему. А в прошлом году российские ученые на основе NSG-мышей создали мышиную модель инфекции ВИЧ-1.
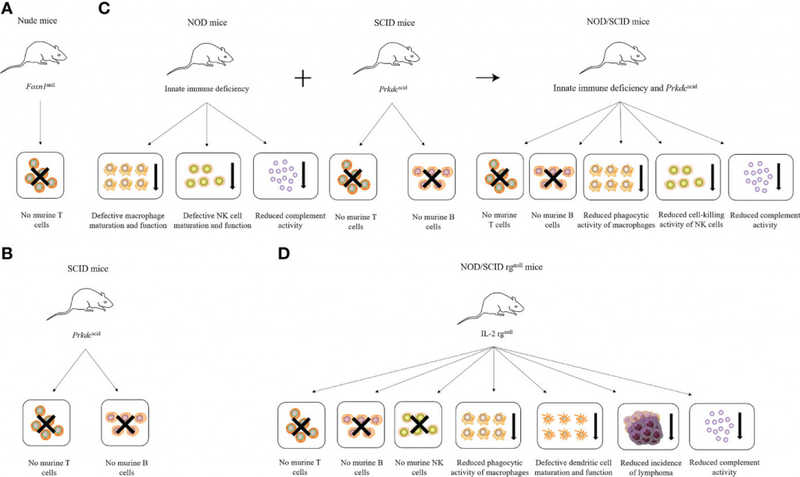 Мышиные модели иммунодефицита: от голых мышей, у которых нарушено только формирование T-клеток, до NSG (NOG/SCID/rgnull) — у них нет функциональных Т-, B- и NK-клеток, снижены функциями макрофагов и дендритных клеток и ослаблена системой комплемента.
Мышиные модели иммунодефицита: от голых мышей, у которых нарушено только формирование T-клеток, до NSG (NOG/SCID/rgnull) — у них нет функциональных Т-, B- и NK-клеток, снижены функциями макрофагов и дендритных клеток и ослаблена системой комплемента.Credit:
Frontiers in Immunology (2022). DOI: 10.3389/fimmu.2022.1007579 | CC BY
Однако несмотря на успехи в этой области, гуманизированные мыши, полученные на основе иммунодефицитных, все еще не лишены недостатков. Например, вторичные лимфоидные органы у таких животных отсутствуют либо обладают аномальной организацией — это может нарушать переключение классов иммуноглобулинов или созревание аффинности после иммунизации. Кроме того, для оптимального приживления гемопоэтических стволовых клеток человека важны человеческие цитокины — их отсутствие в мышином организме затрудняет дифференцировку и созревание функциональных иммунных клеток. Наконец, на приживление человеческих клеток могут влиять не только иммунные клетки мыши (хотя они всё же далеко не всегда оказываются полностью элиминированы из организма животного), но и мышиные эритроциты. Эти проблемы исследователям еще предстоит решить на пути к созданию гуманизированной мыши, надежно воспроизводящей работу иммунной системы человека.
 Credit:
Credit:Павел Русанов


 Меню
Меню





 Все темы
Все темы




 0
0