Маленькие антитела маленьких камелид. Зачем иммунологу альпака?
В крови альпак и других верблюдовых встречается особый класс иммуноглобулинов — тяжелоцепочечные антитела. Их вариабельные фрагменты — нанотела — отличаются малыми размерами и высокой стабильностью. Так ли эта стабильность хороша, чем привлекательна компактность нанотел и за что иммунологи любят альпак? Обо всем этом нашему порталу рассказал Степан Петрович Чумаков, старший научный сотрудник лаборатории молекулярной иммунологии ИБХ РАН.

«Лабораторные» — в широком смысле — животные, ставшие героями нынешнего материала, в этот раз оказываются не вполне лабораторными. Они мирно разгуливают на открытом воздухе по отведенному им участку фермы, и типичные для середины февраля холод и снег, кажется, ничуть их не смущают. Но такая погода должна быть привычной для альпак — исходно обитателей высокогорных Анд, где в основном и разводят этих животных.
 Credit:
Credit:Павел Русанов
Альпаки представляют особый интерес для иммунологических исследований благодаря особым однодоменным антителам. Такая форма иммуноглобулинов уникальна для семейства верблюдовых, если говорить о млекопитающих (кроме них, однодоменные, или тяжелоцепочечные антитела встречаются еще и у акул). На их основе получают нанотела — вариабельные фрагменты однодоменных антител, экспрессированные независимо. О работе с наноантителами альпак нам рассказывает Степан Петрович Чумаков, к.б.н., старший научный сотрудник лаборатории молекулярной иммунологии ИБХ РАН.
К работе с альпаками, по словам Степана, он пришел «практически случайно».
— Моя мать давно увлекается разведением животных. Исходно это были козы и овцы, а идея держать еще и альпак зародилась как-то во время визита в Америку. Как оказалось, разводить их можно, в принципе, в похожих условиях, вся инфраструктура на тот момент тоже уже была. Важную роль сыграл еще и биологический бэкграунд — в какой-то момент появилось желание и решимость завести альпак, и тогда было бы логично пристально изучить их необычный класс антител и использовать их для получения каких-то биологически активных молекул для таргетирования либо опухолевых антигенов, либо вирусных белков.
Но почему именно альпаки?
— Из всех животных, у которых есть тяжелоцепочечные антитела, альпаки, пожалуй, самые простые в обращении. Наверное, на Ближнем Востоке удобнее работать с верблюдами, — рассуждает Степан, — которые там доступнее. Про акул и сложности их содержания я даже не говорю.
 Альпаки в самом деле довольно некрупные представители камелид — рост взрослого животного в холке не превышает метра.
Альпаки в самом деле довольно некрупные представители камелид — рост взрослого животного в холке не превышает метра.Credit:
Павел Русанов
Сейчас на ферме живет около 30 альпак. Недавно родивших самок с детенышами все-таки держат отдельно, в тепле, — к ним нас ведут в первую очередь. Детенышей оказалось трое, самый юный из них родился всего за сутки до нашего визита, самый старший — в декабре. Все три маленьких альпаки уже довольно уверенно стоят на ногах и проявляют любопытство к происходящему. В том числе к морковке в руках репортера, но зубов у малышей еще нет, поэтому им приходится ограничиваться любопытством.
 Credit:
Credit:Павел Русанов
С первыми привезенными на ферму альпаками, признает Степан, были трудности — детеныши порой рождались с летальными патологиями. Однако эта проблема отчасти была решена благодаря обмену с другими фермами, который несколько улучшил генофонд местной популяции.
Наноантитела: когда быть маленьким — это хорошо?
Говоря о преимуществах наноантител в сравнении с полноразмерными иммуноглобулинами, Степан останавливается на нескольких пунктах. Ключевым параметром здесь оказывается размер молекулы.
— Основное их свойство состоит в том, что это один домен, и довольно компактный. Малые размеры обеспечивают высокую тканевую проницаемость, а также теоретически это может помочь терапевтическому нанотелу проникать в какие-то труднодоступные области, например, через гематоэнцефалический барьер. Важную роль играет и структура — такие антитела эволюционировали без легких цепей, которые у обычных антител закрывают некоторые области вариабельного домена. За счет этого в классических иммуноглобулинах присутствует больше гидрофобных участков, которые в наноантителах, напротив, более гидрофильны, и это обеспечивает лучшую растворимость нанотела. Кроме того, дополнительная дисульфидная связь повышает стабильность такой структуры.
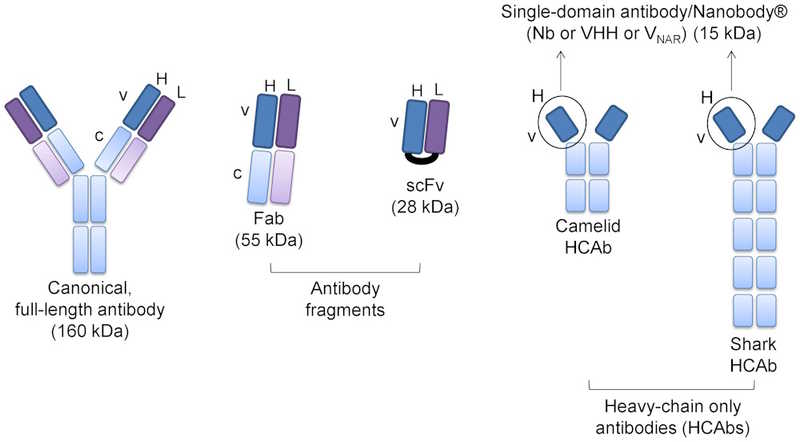 Однодоменные антитела камелид или акул, в отличие от полноразмерных канонических антител, состоят только из тяжелой цепи. Ее вариабельный фрагмент, экспрессированный отдельно, и представляет собой нанотело (или VHH).
Однодоменные антитела камелид или акул, в отличие от полноразмерных канонических антител, состоят только из тяжелой цепи. Ее вариабельный фрагмент, экспрессированный отдельно, и представляет собой нанотело (или VHH).Credit:
Scientific Reports (2014). DOI: 10.1038/srep06760 | CC BY-NC-ND
Иногда, как оказалось, стабильность бывает даже слишком высокой.
— У нас был один проект, в ходе которого мы помогали коллегам в индустрии получить нанотело против Taq-полимеразы. Они хотели производить наборы для ПЦР с «горячим стартом», в которых полимеразная активность блокируется при комнатной температуре нанотелом. Проблемы возникли именно из-за высокой стабильности — при нагреве реакционной смеси до 95 градусов нанотело отсоединялось от полимеразы, но не инактивировалось. При охлаждении до рабочей температуры оно снова связывалось с мишенью, не давая полимеразе работать.
Ещё одно из преимуществ нанотел — это, конечно же, очень простой процесс их селекции.
— В нем нет всей этой комбинаторики, которая связана с тем, что сначала необходимо фаговым дисплеем клонировать в слитом виде тяжелые и легкие вариабельные домены, среди которых получается огромное количество нерабочих вариантов. Среди этого множества молекул, многие из которых только мешают, необходимо выбрать подходящие. И чтобы они не потерялись в этом шуме, размер исходной библиотеки должен быть очень большим. В случае с нанотелами такой проблемы нет — если мы иммунизируем животное, то все варианты, которые есть в библиотеке, так или иначе функциональные нанотела из этого животного. Они могут быть не строго специфичны к целевому антигену, но среди них не будет этого моря неправильно сложенных уродцев.
 Credit:
Credit:Павел Русанов
Как выделить антитела из альпаки?
Как оказалось, на ферме происходит не только иммунизация альпак и последующий отбор крови. Большая часть работы, конечно, осуществляется в Москве, но маленькая лаборатория оборудована и прямо здесь. — Мы пробовали выделять периферические мононуклеары из крови альпак на месте, чтобы затем использовать эти клетки для создания библиотеки и всей последующей работы, — делится Степан. — Но потом все-таки пришли к тому, что для качественного выделения надежнее отвозить кровь в Москву, и сейчас вся логистика устроена именно таким образом. Здесь, на ферме, работаем непосредственно с животными.
 Credit:
Credit:Павел Русанов
По сравнению с более привычными животными, которых используют для получения антител, иммунизация альпак не имеет каких-то ключевых отличий, но сопряжена со своими трудностями. Взять кровь у такого животного — не самая тривиальная задача, особенно если учесть, что образцы берутся из яремной вены.
— Я как-то пробовал сам брать у альпак кровь, — признается Степан, — и аккуратно провести эту процедуру на длинной альпачьей шее, покрытой густой шерстью, довольно непросто. Поэтому сейчас обычно приглашаем ветеринара.
Где нанотело уже нашло свое применение?
Одно из основных направлений исследований лаборатории молекулярной иммунологии, для которых нужны наноантитела, посвящено разработке противоопухолевых препаратов.
— В прошлом году у нас вышла статья про нацеливание наноантител на CD47, один из распространенных иммунных чекпоинтов, который опухолевые клетки используют для обхода иммунной системы. Связываясь с рецептором SIRPα на макрофагах, CD47 блокирует их функцию и позволяет раковым клеткам избегать фагоцитоза. Вполне логичная мишень для противоопухолевой терапии наряду с ингибиторами, например, PD1. Но в отличие от последнего, такое терапевтическое вмешательство будет направлено не на адаптивный, а на врожденный иммунитет. Направление довольно старое, и работа по нему началась давно; сейчас ее, наконец, довели до публикации.
В опубликованной статье предлагается использовать тетрамеры наноантител, нацеленные на уже упомянутый сигнал «не ешь меня» — CD47 на опухолевых клетках.
— Мы иммунизировали альпаку CD47, получили библиотеку нанотел и отобрали из них варианты, которые хорошо связываются с CD47 и блокируют его взаимодействие с серпальфой. Среди них обнаружился как минимум один очень хороший кандидат, который в перспективе можно использовать для создания каких-то терапевтических молекул уже в клиническом аспекте.
На идее применять именно тетрамеры останавливаемся подробнее. Казалось бы, зачем увеличивать размер конструкции, если именно компактность обеспечивает наноантителам более высокую тканевую проницаемость?
— У хорошей проницаемости есть обратная сторона, — объясняет Степан. — При простом введении в кровоток наноантитела не задерживаются почечным барьером и поэтому обладают очень коротким периодом выведения из организма. В тех препаратах, которые предполагаются для использования в клинике, эта проблема частично решается тем, что сама мишень нанотела представляет собой довольно крупный белок, и терапевтические наноантитела задерживаются именно в комплексе с ним. Другой стратегией может быть создание мультимеров. Нанотела можно связывать с задерживающей их конструкцией либо экспрессировать в слитом виде несколько штук. Мы, в частности, работаем с системой, которая позволяет при помощи клик-химии связывать нанотела в тетрамер на основе функционализированного разветвленного полиэтиленгликоля. Такие молекулы, во-первых, будут обладать большей авидностью и, как следствие, аффинностью к мишени за счет того, что у них несколько доменов. Во-вторых, они не будут так легко экскретироваться почками. Это, конечно, может влиять и на доступность в тканях, но так или иначе существуют способы варьировать размер и за счет этого регулировать баланс между проницаемостью и скоростью полувыведения.
Трудности гуманизации?
Когда речь заходит о применении наноантител альпаки для лечения заболеваний человека, возникает вопрос об иммуногенности препарата и о возможных трудностях гуманизации терапевтических антител.
— Собственного опыта в гуманизации альпачьих антител у меня нет, мы работаем на более ранней стадии. Но, в принципе, по своей аминокислотной последовательности альпачьи антитела очень близки к соответствующим доменам человеческих — ближе, чем кроличьи или мышиные. Кроме того, они достаточно низкоиммуногенны сами по себе. Я читал работу, которая описывает довольно простой механизм гуманизации.
Терапевтические антитела уже постепенно вводятся в клиническую практику. В 2019 году FDA одобрило каплацизумаб— препарат наноантител для лечения приобретённой тромботической тромбоцитопенической пурпуры.
— Кроме того, насколько мне известно, есть применяемое в клинике нанотело к фактору некроза опухоли TNFα, а в Китае также используется нанотело к PD-L1. Ну, и есть один вариант CAR T-терапии, в которой нанотело используется в качестве мишень-связывающего домена химерного антигенного рецептора. Это довольно логичный выбор, потому что нацеливающий домен, сделанный из обычного антитела, представляет собой одноцепочечный вариабельный фрагмент (scFv). Многие варианты хороших терапевтических антител в таком формате работают плохо, но у нанотел подобной проблемы нет.
 Credit:
Credit:Павел Русанов
О планах и перспективах
В декабре прошлого года коллектив под руководством Степана опубликовал статью, посвященную точному нацеливанию вирусных векторов на определенные клеточные популяции. В этой работе мишенью послужил белок программируемой клеточной смерти PD-1, который оверэкспрессируется на Т-лимфоцитах, инфильтрирующих опухоль. Регуляторные Т-клетки в опухоли, экспрессирующие PD-1, подавляют иммунный ответ через FOXP3. Исследователи ингибировали экспрессию этого регуляторного белка с помощью коротких образующих шпильки РНК (shRNA), доставляемых в составе лентивирусных векторов. Для специфичного нацеливания вектора на активированные регуляторные T-клетки использовали как раз наноантитела, специфичные к PD-1. Это позволило избирательно доставить shRNA, практически не затрагивая наивные Т-лимфоциты, и тем самым уменьшить супрессивную активность PD-1+ Т-регуляторных клеток.
 Credit:
Credit:Павел Русанов
Еще одно из направлений посвящено применению наноантител в качестве адаптерных конструкций — с их помощью можно точнее нацеливать онколитические вирусы на мишень.
— Сами по себе вирусные онколитики показали себя достаточно эффективным средством противоопухолевой терапии, но они, как правило, довольно неспецифически связываются с клетками. Это несколько снижает эффективность, например, задерживая терапевтический вирус в печени, и вынуждает использовать большее количество препарата для введения пациенту. В случае нацеливания на опухолевый антиген количество препаратов можно уменьшить, что снизит, во-первых, стоимость производства, во-вторых, частоту и тяжесть потенциальных побочных эффектов, сделав этот вид терапии еще более привлекательным.В этом смысле нанотела могут оказаться очень удачным инструментом, как для создания рекомбинантных вирусов, где нанотела используются совместно с белком оболочки, так и для создания адаптерных конструкций. Мы сосредоточились именно на втором варианте — в нем адаптеры конструируются отдельно, а затем вводятся одновременно с вирусом, что может обеспечить модульный подход к терапии. Один и тот же онколитический вирус в сочетании с разными адаптерными молекулами можно нацеливать на различные опухолевые антигены.
— Сейчас именно это направление работы интересует меня больше всего, — подытоживает Степан. — Мы как раз делаем нанотела, которые позволят захватывать вирусный белок и, будучи слиты с опухоль-специфичным нанотелом, нацелят вирус на опухолевые клетки. Я очень надеюсь, что в скором времени у нас будет рабочий прототип адаптерной конструкции.
 Старший научный сотрудник лаборатории молекулярной иммунологии ИБХ РАН Степан Петрович Чумаков.
Старший научный сотрудник лаборатории молекулярной иммунологии ИБХ РАН Степан Петрович Чумаков.Credit:
Павел Русанов
О других модельных животных на PCR.NEWS:


 Меню
Меню





 Все темы
Все темы




 0
0