Опасные связи для нашего мозга: глюкокортикоиды, гиппокамп, нейровоспаление
Наталия Гуляева сформулировала гипотезу общего происхождения различных заболеваний мозга — деменции, в том числе болезни Альцгеймера, депрессии, эпилепсии и других. Гипотеза в том, что у всех этих заболеваний есть триггер — дистантное поражение гиппокампа кортикостероидами. Эта работа строится на анализе литературы, с одной стороны, а с другой — на собственных «мокрых» исследованиях автора.

Наталия Валерьевна Гуляева — доктор биологических наук, профессор, руководитель лаборатории функциональной биохимии нервной системы Института высшей нервной деятельности и нейрофизиологии РАН, руководитель отдела научно-практического психоневрологического центра им. З.П.Соловьева ДЗМ (Москва).
Часть целого
Наталия Валерьевна, как вы пришли к этой гипотезе?
Отправных точек было несколько. Я окончила кафедру биохимии биологического факультета МГУ у Сергея Евгеньевича Северина. Когда я там училась, она была одной из самых популярных — тогда вообще молекулярные кафедры были очень популярны. Наша кафедра давала потрясающее образование, ее выпускники успешно работали и работают в самых разных областях биологии и медицины. Но вот мозги после выпуска настроены на очень узкую тему. Ведь как тогда была устроена работа на кафедре? Человек занимался своей маленькой темой. Вот я, например, делала диссертацию по ферменту киназе фосфорилазы b, и целая группа этим занималась. А вот для чего это — ну, кроме собственного удовольствия и углубленного знания — вопрос не стоял. Никто не связывал это с тем, как работа фермента встроена в организм. И мы тогда немного свысока смотрели на физиологов — во-первых, кафедры эти были не очень популярны, во-вторых, нам казалось, что физиология — это что-то очень отсталое.
Это и в мое время было, в 90-е. А когда вы заканчивали?
Я заканчивала в семьдесят четвертом, а в семьдесят седьмом — аспирантуру. Знаете, если бы я после этого не пошла работать в Институт высшей нервной деятельности и нейрофизиологии, я бы, наверное, всю жизнь так и считала, что мы такая белая каста — мы, которые понимаем молекулярные механизмы... Но когда ты начинаешь работать с мозгом, в какой-то момент понимаешь, что этот мелкий кусок, который ты исследуешь, нужно куда-то приложить — а как приложить, ты не знаешь. И поэтому большое счастье для меня, во-первых, что я работала с физиологами, которые говорили на другом языке, и я научилась их понимать и встраивать свои мелкие молекулярные достижения в общие физиологические процессы. И второе счастье, что лет 15 назад на меня вышли клиницисты, которые занимаются неврологией и психиатрией. Когда ты можешь подстраивать клинические исследования под экспериментальные, а эксперимент делать по тем идеям, которые возникают из клинических данных, это и есть настоящая трансляционная медицина, о которой все говорят, но почти никто не имеет возможности так работать. Я считаю, это заслуга профессора Аллы Борисовны Гехт, которая сейчас руководит научно-практическим центром психоневрологии. Потому что лет 15 назад она прослушала мой доклад в академии, подошла на кофе-брейке и говорит: «Наталия Валерьевна, мы с вами будем вместе работать». Я тихо похихикала, но Алла Борисовна человек очень волевой, и вот смотрите, мы сейчас работаем, и работаем успешно.
Апоптоз и память
А до этого вы занимались болезнями? В какой области работали в тот момент?
Области до этого были разные. Меня всегда интересовали механизмы стресса. Вначале это была биохимия свободных радикалов. То, что называют относительно примитивно «перекисное окисление липидов». У нас была блестящая школа Института химической физики академика Николая Марковича Эмануэля, а в биологию это внедрила профессор Бурлакова Елена Борисовна. К сожалению, их сейчас уже нет. Дальше свободнорадикальная история очень логично перетекла в историю про оксид азота. Она была тоже очень популярна, и не только благодаря виагре… Был введен термин «окислительный стресс», кстати, очень плохой, потому что термин «стресс» был занят Гансом Селье...
Ну почему? В одном случае — про клетки, в другом — про физиологию…
А есть еще «клеточный стресс», дальше возникло понятие «нитрозативный стресс» — те нехорошие события, которые обусловлены избытком оксида азота и его взаимодействием со свободными радикалами кислорода, в частности, с супероксидом. И вот по мере работы я поняла вещь очень неприятную для исследователя с точки зрения методологии: начали появляться данные о том, что без наличия определенного уровня супероксида нервная клетка не работает. А дальше выяснилось, что без оксида азота, который такой страшный и дает нитрозилирование белков и смерть, — без оксида азота нет памяти. Затем, есть такое понятие, как эксайтотоксичность — страшная вещь, когда у нас избыток возбуждения, много возбуждающих аминокислот, они стимулируют окислительный стресс, нитрозативный стресс, и гибель, гибель, гибель. Но именно аминокислота глутамат является тем нейромедиатором, который обеспечивает нашу память в глутаматергической системе! Кстати, на пике исследований эксайтотоксичности синтезировалось очень много соединений, которые должны блокировать именно глутаматергическую трансмиссию. Но все провалилось. Вы блокируете систему, у вас нет эксайтотоксичности, нет гибели нейронов, но нет и памяти.
И еще одна история из моих предыдущих исследований связана с модным тогда направлением — апоптозом.
В девяностые этим все занимались, помню.
Да, наш блестящий нейроморфолог Илья Васильевич Викторов — тоже, к сожалению, покойный, — назвал это апоптопсихозом. Так вот, мы знали, что нет ничего страшнее, чем фермент каспаза-3, который режет белки в клетках, и в результате апоптоза эти клетки погибают. И вдруг мы выяснили, что если вы блокируете этот фермент, то животное ничего не помнит.
Вы работали на каких-то клеточных моделях или на организмах?
В основном на выделенном мозге крыс. Ну и на животных тоже. У нас есть работа, очень неплохо цитируемая, где мы показали, что если животным в критический период развития, — у крыс это где-то вторая неделя, когда закладываются основные функциональные связи в мозге, — если им ввести ингибитор этого фермента, то связи закладываются аномально и существенно меняется пластичность мозга. И я тогда написала большую статью-обзор «Неапоптотические функции каспазы-3 в мозге». Но все еще сложнее, потому что апоптотическая гибель не является патологией. Например, каким образом гибнут сперматозоиды? Оплодотворит один, а остальные же гибнут как-то, правильно? Они гибнут апоптотически. Менструальный цикл — как гибнет яйцеклетка? Она гибнет апоптотически. В чем разница между апоптозом и некрозом? В том, что апоптотически клетка погибнет сама, а некротически — клетка выпустит из себя лизосомы, ферменты, и вы получите целый некротический очаг. То есть апоптоз — гибель адаптивная, поэтому рассматривать его как чисто патологический процесс невозможно.
И в итоге все сложилось в вывод, что в организме не заложены специальные механизмы для патологии. Значит, все механизмы, которые в норме работают, могут стать патологическими.
Природа сделала так, что механизмы нормального функционирования и гибели одни и те же, но они различаются — таймингом, интенсивностью, локализацией в клетке. И следующий вопрос мы себе задаем: а зачем? Чего не будет, если вы эти механизмы разделите? Например, пошла бы так эволюция, что патологические механизмы включаются, когда нужно убить что-то, а нормальные механизмы совершенно другие, на других молекулах, на других сигналах. Почему этого не произошло?
И почему?
Адаптация. Есть такая вещь, как пластичность мозга — возможность мозга изменяться адаптивно, как правило, приспосабливаясь к любым ситуациям. В частности, изменяются синапсы как основная единица межнейронного взаимодействия — это молекулярный уровень. Но и выше тоже — перестраиваются целые нейронные сети, одна часть мозга берет на себя функции другой, одно ядро берет функции другого, и так далее...
Континуум пластичности и патологии
Здесь мы подходим к главному: как вы различаете, это норма или патология? Ладно, когда умер человек, тогда, наверное, это не норма. Но остальное? И мне придется сделать еще один экскурс, наверное, последний, прежде чем перейти к гиппокампу. Как я говорила, меня очень интересовали механизмы стресса, и я общалась с нашими адаптологами, ведущим был Феликс Залманович Меерсон, к сожалению, его уже тоже нет, он был кардиолог и адаптолог. А буквально через пять-десять лет это же в других формулировках описал Брюс Мак-Ивен, знаменитый американский адаптолог, который ввел понятие «аллостаз»: измененное состояние, еще адаптивное, но уже близко к дезадаптивному.
Так вот, лучше всех это объяснял Меерсон. Он говорил: «Гипертрофия левого желудочка — это норма или патология?» Ему говорили: «Конечно, это патология». Он отвечал: «Но и у большинства спортсменов это происходит. Что же, они все больные?» И он очень остроумно ввел понятие «адаптации с высокой структурной ценой». Например, гипертрофия левого желудочка — это та адаптивная патология, которую тронь, пережми — и она перейдет в патологию. Нужно же как-то назвать, да? Мак-Ивен это назвал «аллостаз», и он никогда не ссылался на Меерсона — я всегда иронически пишу в статьях на эту тему, что, поскольку Меерсон большую часть публиковал на русском языке, видимо, просто некому было перевести.
Давайте вернемся к мозгу и его пластичности.
Да. Вы знаете, у кого мозг самый пластичный? У больных эпилепсией. Развитие эпилепсии — это непрерывное образование новых отростков и циркуляция по ним возбуждения, это называется «аберрантная пластичность». Она же и убьет эти клетки, поскольку там слишком много возбуждения, слишком много глутамата. В девяностые годы появились две статьи английских исследователей, которые изучали эпилептическую активность при длительной потенциации. И они в некотором шоке написали, что они не видят разницы между пластичностью и патологию — они видят континуум состояний. Норма, адаптация и патология — все это основано на одних механизмах. Как говорил в своих лекциях один достойный ученый: «Нет патологической физиологии, есть патологические физиологи». Вот эта глобальная история с нормой и патологией меняет понимание того, какая должна быть стратегия в медицине. Потому что часто лечат проявления адаптации, понимаете?
Но ведь даже из общих соображений это настолько очевидная вещь — что одни и те же механизмы у нормы и патологии!
Вот, смотрите, вас это зацепило. Когда я поняла, что это очевидно, я подумала: наверное, изобрела велосипед. Но поверьте, я это искала в литературе. Почти никто об этом не говорит. Есть две, по-моему, работы, за которые я смогла зацепиться, более поздние, — они не говорят о континууме, но говорят, что есть разные состояния, по крайней мере для мозга. Это не пользуется популярностью, потому что это сложно доказуемо. Никто не возражает, но мало кто хочет на эту тему теоретизировать.
Получается, что вы раз за разом в работе натыкались на общие механизмы для нормы и патологии и так двигались к формулировке вашей гипотезы? От общего к частному?
Совершенно верно, именно так. И особенно, конечно, с каспазой, потому что мы были практически первые, кто показал ее неапоптотическую функцию.
Есть еще одна вещь, которая ложится в эту концепцию о континууме, — оказалось, что у нашей каспазы-3 несколько сотен доказанных субстратов! И у многих ферментов так. Я вам объясню, как происходит выбор субстрата. Клеточная среда — это не жижа. Все находится в компартментах. Как осуществляется регуляция активных ферментов? Через компартменты: что ему клетка в своем компартменте подсунет, то он и сожрет. А уж как бог устроил, что «в должном месте в должное время совершит должное» — мы не знаем. Но мы знаем, что вся система сигнализации работает на протеинкиназах, протеинфосфотазах и протеазах. И это самые неспецифичные ферменты.
Депрессивная крыса с эпилепсией
Вот такая история, все в копилку общих механизмов и континуума различных состояний на разных уровнях. Собственно говоря, когда это стало потихоньку входить в некоторое — я не могу сказать «понимание», представление — потому что это все нужно как-то доказывать... И когда я начала работать с клиникой, я столкнулась тем, что называется коморбидностью. Это сосуществование одновременно нескольких заболеваний в одном организме, человеческом или крысином. Например, депрессия и деменция. Я проанализировала всю теорию коморбидности с шестидесятых-семидесятых годов до наших дней. До сих пор рассматривается такая возможность, как случайная коморбидность, во что я совершенно не верю, но большинство уже говорит об общих механизмах. Кстати, у нас в лаборатории — это не мои группы, — доктор Саркисова Карине Юрьевна много лет изучала крыс с генетической эпилепсией, линии WAG/Rij. И она первая, кто показал, что у них же генетическая депрессия.
А как у крысы, извините, выглядит депрессия?
Да, это хороший и очень грустный вопрос. К сожалению, сейчас, после десятков лет работы в этой области, я вынуждена признать, что наши поведенческие подходы очень несовершенны. У человека депрессия диагностируется, если есть несколько возможных признаков — например, осознание своей ненужности, склонность к суициду, ангедония, когда ничего не вкусно, ничего не хочется, ничего не нравится. Вот когда их несколько, ставится диагноз «депрессия». А у крысы — она тебе не скажет, что хочет покончить с собой — использовался тест Порсолта, вынужденное плавание: антидепрессанты заставляют крыс более активно выбираться из воды. Из этого был сделан вывод, что, если животное, которому не давали препаратов, но что-то с ним сделали, менее активно плавает — значит, оно депрессивноподобное. Это неправильно. Но есть одна зацепка — хилая, сразу говорю, хилая. Это ангедония. Крысы любят сладкое. Если вы им делаете так называемый тест предпочтения сахарозы, то есть даете им выбор между двумя бутылочками — в одной сладкая водичка, а в другой простая, то, как правило, после тяжелых или долгих стрессов животные перестают пить много сахара. Из этого мы, люди, делаем вывод, что они перестают наслаждаться жизнью.
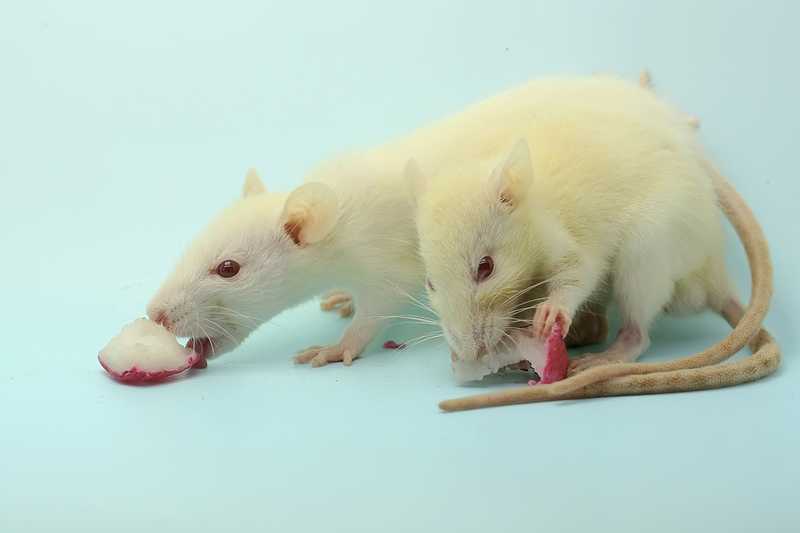 Если крыса не хочет сладкого, это считается признаком депрессии. Credit: 123rf.com
Если крыса не хочет сладкого, это считается признаком депрессии. Credit: 123rf.com
Так вот, смотрите, болезни мозга. Коморбидность неврологических и психических заболеваний. Деменция, депрессия; деменция, депрессия, эпилепсия; эпилепсия, депрессия; эпилепсия, деменция. Все эти варианты есть. Причем с деменцией вообще очень интересно. Сегодня, например, самая распространенная деменция — это болезнь Альцгеймера. По коморбидности болезни Альцгеймера с депрессией уже были проведены мощнейшие исследования в клинике. Вывод на сегодня: не просто болезнь Альцгеймера у многих пациентов коморбидна с депрессией, но депрессия является предшественником болезни Альцгеймера, и наличие депрессии — мощнейший фактор риска развития болезни Альцгеймера.
А это просто предшественник или именно триггер?
Ну, фактор риска — значит, и триггер тоже, конечно… Теперь эпилепсия. Есть одна зарубежная работа обзорного характера, вывод которой в том, что эпилепсия — это болезнь стресса. А значит, там будет и депрессия, а поскольку при эпилепсии происходит нейродегенерация как раз в мнемонических зонах мозга, то там будут, и когнитивные нарушения, включая деменцию. Эпилепсия, которая примерно в 10% случаев у взрослых развивается после инсульта и после черепно-мозговой травмы — это всегда эпилепсия височной доли. Она еще и очень часто фармакорезистентная, то есть вы не можете снять эпилептические приступы фармпрепаратами, человек идет на операцию. На прогрессирующей стадии этой эпилепсии гиппокамп склеротизируется. Так вот, что объединяет деменцию, депрессию и эпилепсию? Эти три распространенные и социально значимые заболевания?
Наверное, гиппокамп?
Именно. Гиппокамп, это часть старой коры, часть височной доли. Его очень любят исследователи, знаете почему? Потому что, когда вы его разрежете, видно — вот такая зона, такие клеточки, сякие клеточки. Мало того, что гиппокамп состоит из разных полей, но у него еще есть так называемый септотемпоральный, или дорсовентральный, градиент. То есть, если вы вдоль гиппокампа идете, меняется и клеточный состав, и, главное, меняется функция. Дорсальный гиппокамп (у грызунов) — задний у человека —отвечает за когнитивную функцию. И он связан нервными связями с септумом (перегородкой), он связан с некоторыми областями коры, в частности, с префронтальной корой — это сознание, это определенные формы обучения и памяти. А гиппокамп передний у человека (вентральный у грызунов) — это эмоции. Он связан с миндалиной (амигдалой), с гипоталамусом, и он регулирует систему, которую называют «гипоталамо-гипофизарно-надпочечниковая ось».
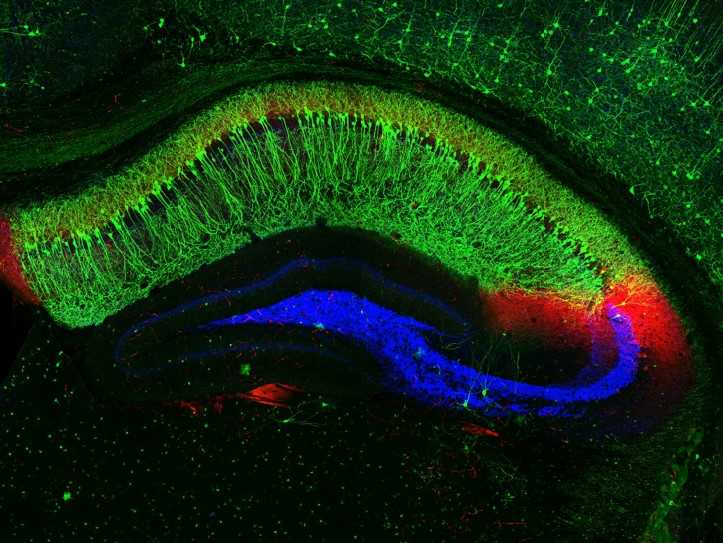 Срез гиппокампа мыши. Фото: NIH | flickr.com
Срез гиппокампа мыши. Фото: NIH | flickr.com
И вот из всех предпосылок, о которых я говорю, я сформулировала гипотезу о том общем, что объединяет различные заболевания мозга, — дистантное поражение гиппокампа глюкокортикоидами [1, 2, 3, 4, 5].
Причем тут стресс
Эта гипотеза появилась в голове как «бумс», или это результат какого-то медленного накопления?
Это все на старых дрожжах, с самых, что называется, ранних лет, когда я глубоко влезла в концепцию стресса и поняла, как работает стресс-реализующая система — гипоталамо-гипофизарно-надпочечниковая ось, — это одна линия была. Вторая линия: меня всегда очень интересовало, почему гиппокамп такой, что называется на английском, selective vulnerable. То есть селективно чувствительный к различным повреждениям, к любым: к гипоксии, к облучению, к эксайтотоксичности, да к чему угодно. У нас была работа, например, очень простой эксперимент — делаем животному тяжелый хронический стресс и после этого стресса смотрим всего два показателя: количество кортикостерона (аналог кортизола у мышей и крыс) и интерлейкин 1-бета, который указывает на воспалительный процесс. И видим, что накопился кортикостерон и интерлейкин и в гиппокампе, и в коре. А потом взяли их через месяц — и в коре все нормально, а в гиппокампе торчит этот кортикостерон, торчит интерлейкин. То есть вот эта селективная чувствительность гиппокампа, не я ее придумала — ее отмечали, работы по ишемии в основном. Ее отмечали и говорили: «господи, почему так?». Это начал совершенно потрясающий Роберт Запольски в США — тот знаменитый ученый, который год или два жил с павианами и исследовал, как стрессорные факторы на них влияют. Но у него мощнейшая лаборатория была, и он тоже показал, что при самых различных стрессорных воздействиях почему-то проблемы возникают в гиппокампе. А за последние десять-пятнадцать лет стало понятно, как действуют глюкокортикоиды, то есть кортикостерон и кортизол.
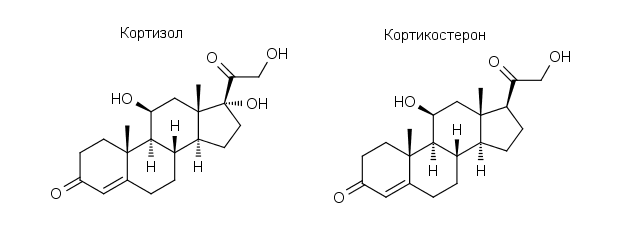 Кортизол — гормон человека, защищающий от стресса, — и кортикостерон, который выполняет аналогичные функции у грызунов
Кортизол — гормон человека, защищающий от стресса, — и кортикостерон, который выполняет аналогичные функции у грызунов
А раньше было непонятно?
Тот самый Брюс Мак-Ивен, который ввел понятие «аллостаз», в конце девяностых показал, что если ввести животному меченый кортикостерон, то метка обнаруживается в мозге. И первые рецепторы глюкокортикоидов, которые открыли, — типичные цитозольные рецепторы, для других стероидов они были уже известны очень давно. Ведь нет барьеров для глюкокортикоидов, они маленькие и липофильные, все мембраны проходят, просто обычная диффузия. Они входят в клетки, там связываются с рецептором, рецептор в виде комплекса с глюкокортикоидом ползет в ядро, и там на определенных участках ДНК начинается даже не индукция, а дерепрессия. Этот комплекс работает как транскрипционный фактор, и начинается экспрессия каких-то генов. При этом уже знали, что есть два типа таких рецепторов по сродству. И жили так некоторое время, но оказалось, что если вы вводите глюкокортикоиды, либо in vitro на мозг апплицируете, либо in vivo в мозг — то реакция мозга практически мгновенная. Происходит деполяризация мембран со всеми проистекающими оттуда последствиями, много-много других событий, которые занимают секунды.
А так не должно быть в цитозольной схеме?
Конечно, нет. Экспрессия генов — ну, начало при хорошем раскладе через два часа, плато через шесть. А дальше выяснилась фантастическая история, которую я не могла несколько лет понять. Вдруг обнаружились мембранные рецепторы глюкокортикоидов. И получается следующая история. Вот представьте себе — стресс какой-то, да? И у вас начинается быстрое повышение уровня глюкокортикоида в крови, сразу такое же в мозге, поскольку барьеров нет. И потом он выходит на плато, а дальше может быть что угодно. Вы продолжите стресс — уровень будет какое-то время держаться, нет — он упадет. И что получается: сначала идет связывание с первым типом рецепторов, так называемыми мембранными минералокортикоидными рецепторами, сразу открываются какие-то ионные каналы, и происходит деполяризация мембраны. А дальше потихоньку повышается концентрация, и начинается оккупация рецепторов второго типа — глюкокортикоидных, которые тоже меняют свойства мембраны, но более длительно, минуты, десятки минут. И затем уже цитозольные. Сейчас это так и называется: геномные эффекты глюкокортикоидов, за счет цитозольных рецепторов, и негеномные, за счет мембранных рецепторов. Почти на всех клетках организма есть рецепторы глюкокортикоидов. То есть сначала — мембранные минералкортикоидные рецепторы, потом — мембранные глюкокортикоидные, потом цитоплазматические те и другие.
«Быстрые» рецепторы особенно характерны для мозга, там их максимальная плотность. А как они в мозге распределены? Оказывается, их очень много в гиппокампе, дальше в амигдале, фронтальной коре... По концепции стресса глюкокортикоиды будут регулировать все, это расписанные метаболические эффекты в печени, в почках, в клетках крови — везде. Но чем отличается мозг? Тем, что он и запускает стрессореализующую систему. Получается, мозг: А — триггер, Б — первичная мишень. Это нам дает очень быстрый пластичный ответ. Для чего все эти быстрые деполяризации? Чтобы вы поведением быстро ответили на стрессорный фактор. Ведь это же подложка поведения — мембранный потенциал нейрона. И поэтому мы уже не удивляемся, что фоном для многих заболеваний мозга — и неврологических, и психологических — будут нарушения этой системы.
Гиппокамп, на котором сходится всё
Если такая хорошая система с множеством обратных связей, почему она ломается?
Потому что если вы реагируете прекрасно, аплодисменты вашей быстрой адаптации. Если вы избежали стрессорного фактора — убежали, вам хорошо, всё, плевать. Но если, условно говоря, вас посадили черти на сковородку, поджаривают и уйти не дают? У вас эти глюкокортикостероиды будут долбить рецепторы гиппокампа и сидеть там так, как у нас было после хронического стресса — помните, эта работа, о которой я говорила.
А в норме, когда стресс уходит, есть специальные ферменты, которые это все убирают?
Убирают, конечно, все это быстро утилизируется. Стресс-реактивность организма — вещь адаптивная, но есть разные стрессорные факторы — ишемия, дали просто по голове, отравили... И может произойти, если в терминах адаптологии, дезадаптация. Вы спрашивали, откуда эти идеи возникли? Значит, смотрите, что мы знаем: есть гипоталамо-гипофизарно-надпочечниковая система, вот так работают ее рецепторы, и гиппокамп набит этими рецепторами. Второе, что мы знаем: гиппокамп почему-то селективно чувствителен ко всему. Третье, что мы знаем: почему-то там действительно может накапливаться кортикостерон, и нейровоспалительный процесс очень быстро развивается. Кстати, потом в разных экспериментах это подтвердили. И сейчас мы бьемся, мы не можем найти, и не только мы, вот эту основу — механистическую связь между глюкокортикоидом, который сидит на рецепторе, и активацией нейровоспаления. В клинике глюкокортикостероиды последние сто пятьдесят лет используются как противовоспалительные.
Да, я сам преднизолон принимаю при приступах астмы.
Глюкокортикостероиды, да, противовоспалительные — я могу in vitro это показать. А когда ты вводишь их in vivo, часто бывает, что ответ провоспалительный. И мы не можем найти механизм, когда он будет «противо», а когда «про». Вот когда избыток глюкокортикоидов, избыток кортизола — мы же видим провоспалительные изменения в организме, а как они связаны, мы не знаем. Ну это, что называется, a propos. Я к тому, что это история с континуумом и с тем, что механизмы нормы и патологии — это одни и те же механистические цепи, просто в разных условиях по-разному запущенные, но компоненты те же, химия та же.
А в клинике как это выражается?
Мы знаем, что в клинике деменции, и прежде всего альцгеймерского типа, гиппокамп играет важную роль — дисфункция гиппокампа и его структурные изменения там показаны. Эпилепсия височная — это просто склероз гиппокампа. Депрессия — это изменения гиппокампа. А мы же еще должны сказать одну страшную вещь. Гиппокамп — это одна из двух доказанных нейрогенных ниш в организме, то есть в гиппокампе всю нашу жизнь образуются новые нейроны. (Подробнее об этом см. интервью с Григорием Ениколоповым. — PCR.NEWS.) Зубчатая фасция, или зубчатая извилина, гиппокампа, это та нейрогенная ниша, — как считают, но пока не могут нормально доказать, — которая имеет отношение к замене нейронов. Причем в тех цепях, которые отвечают за поведение, память, обучение, эмоции. Более того, и в наших экспериментах, и у других мы показываем, что если есть избыток глюкокортикоидов, то зубчатая извилина теряет свои нейроны быстрее всего. Одновременно при избытке глюкокортикоидов, то есть кортикостерона, — это, конечно, показано на животных, — происходит подавление нейрогенеза. То есть, видите, есть гиппокамп, на котором сходится все. Он может все, но он платит за это тем, что он селективно чувствителен к повреждающему воздействию.
Чем сложнее конструкция, тем больше уязвимых точек.
Ну да, и так тоже. И еще давайте вспомним то, о чем мы говорили в начале, — нейротрансмиссия в гиппокампе. Там очень много глутаматергических нейронов, значит, он к эксайтотоксичности очень склонен, а результат нехороший, нейродегенерация. В одном из обзоров я расписала огромную схему: весь глутаматергический синапс забит рецепторами, я там каждый путь от каждого рецептора обозначала цифрой, и последняя цифра то ли 17, то ли 18. Просто представьте себе этот синапс, где идет глутаматергическая трансмиссия — насколько она важна для организма, что она так тонко регулируется. Но столько рецепторов глюкокортикоидов всех четырех типов, сколько там есть — нет нигде. Почему на фоне стресса все лучше запоминается? Потому что кортизол или кортикостерон у крыс стимулирует выброс глутамата. Но если вы будете глюкокортикоидами перегружать, то получите избыток глутамата и эксайтотоксичность, опять через тот же механизм, только избыточный. Мы недаром начали с общности механизмов нормы и патологии...
Пока мы говорим только о трех, условно, заболеваниях, но поверьте, что это можно распространять и на другие заболевания. С этими мне проще. В них задействован гиппокамп, в них он страдает, и они часто коморбидны.
Кортизол в волосах
Логично предположить, что основа коморбидности — это дисфункция гиппокампа. Теперь: почему дистантное поражение? Вот, смотрите: например, эпилептические события часто возникают после черепно-мозговой травмы или после инсульта. При эпилепсии страдает гиппокамп. Как отдаленные последствия инсульта, черепно-мозговой травмы, деменция и депрессия хорошо известны, можно сказать, коморбидны. Но где происходит черепно-мозговая травма, затрагивает ли она гиппокамп? Да вам нужно полчерепа снести, чтоб она затронула гиппокамп!
Значит, это вторичное повреждение. При черепно-мозговой травме, при инсульте идет мощнейшая активация гипоталамо-гипофизарно-надпочечниковой оси.
Для начала это тяжелый стресс. А дальше очень интересно: и при черепно-мозговой травме, и при инсульте мало того, что уровень кортизола высокий — уровень кортизола определяет исход. Я намеренно объединяю разные заболевания, потому что я считаю, что у них одна основа. То есть кортизол в остром периоде является фактором, который определяет исход: выздоровеет ли пациент, и как он выздоровеет. Однако кортизол совершенно не определяет неврологический дефицит.
Что это такое и почему важно?
Неврологический дефицит — то есть человек плохо ходит, плохо говорит, — определяется тем, какие части мозга попали под инсульт или черепно-мозговую травму. Вот, условно говоря, инсульт в области двигательной коры. Гиппокамп еще ни при чем. Вот есть корреляция с возникновением деменции, с возникновением депрессии, но нет корреляции с неврологическими дефицитами. А с точки зрения вторичного, отдаленного повреждения, в результате которого возникнет депрессия, когнитивные нарушения, кортизол — мощнейший фактор, который предсказывает исход. Это показано во многих исследованиях. И более того, ряд исследователей показывают, что, если высокий уровень кортизола сохранится хотя бы несколько дней после повреждения мозга, то это больные, у которых точно будет или более высокая смертность, или намного более высокий риск развития деменции и депрессивных расстройств.
Я видел вашу работу по исследованию кортизола у больных. Меня поразило, что кто-то придумал по волосам определять содержание кортизола в предшествующий инсульту период. Ваша разработка?
Исследовать волосы на кортизол придумали не мы, это придумали очень давно те, кто стал исследовать стресс у детей. Неинвазивно можно смотреть кортизол в моче и в волосах. Но в чем прелесть волос: к вам приходит больной, у него инсульт, вы не знаете, что с ним было раньше, но вы взяли волосы и все видите. Взяли сантиметр от скальпа — и вы знаете, что это примерно за последний месяц он столько кортизола накопил в волосах. Причем очень интересно, мы после этого напечатали статью про кортизол в крови и в волосах у женщин с депрессией. Так вот, он понижен у женщин с депрессией, потому что депрессивный пациент непрерывно эксплуатирует эту систему. История фантастическая, которую невозможно объяснить, — у них повышен кортизол в крови и понижен в волосах. Очень трудно разобраться задним числом, но мы это стараемся делать.
А как это делается? Приходит лаборант, отрезает прядь волос, или с луковицами нужно выдернуть?
Нет, конечно, не с луковицей. Там на самом деле нужно всегда брать из определенного участка головы эти волосы, — окраска, кстати, не влияет, так что у женщин тоже можем брать, — и дальше берется прядь, просто сбривается, и из нее отрезается нижний сантиметр. Условно говоря, последний месяц. Дальше идет растворение этих волос, экстракция кортизола и определение кортизола иммуноферментным анализом.
А если по другим сантиметрам посмотреть, такая машина времени получится?
Вы знаете, наверняка кто-то это делал, и нам хочется посмотреть все, но рук мало, денег мало, сил мало. Ведь и у больных с инсультом никто не делал до моего любимого израильского исследования TABASСO, за которыми мы пошли. А в целом очень много работ. Про детей с кортизолом в волосах я нашла намного больше, чем про взрослых. Это не обязательно клиника: например, в каких-то группах занимаются с неблагополучными детьми, исследуют их способы справляться со стрессом.
Параллельно у вас идут работы на животных. Там модели делаете?
Да. Мы же напечатали работу по черепномозговой травме, где параллельно показали результаты клиники и эксперимента, и показали, как они похожи. Чем сложны эксперименты в клинике? Вы получаете больного, когда он уже заболел, трудно отмотать назад. С животными вы можете смоделировать все.
Как моделируется стресс на крысах? Электричество на сетку под лапы подают?
Можно как угодно, но да, я взяла эту вот жесткую, очень старую модель, потому что точно знаю, что она дает тяжелый хронический стресс. Три недели крысу на сетке лупят электричеством, при этом ей дают вспышку света — как бы в связи с электричеством и как бы не в связи, то есть у нее не может выработаться условный рефлекс, поскольку вспышки стохастические. После этого ее до конца дня озвучивают белым шумом, это очень тяжелый стрессорный фактор. У нас вообще-то десятки моделей, но если задача делать грубую модель… Был условный контроль, часть животных вывели после одного дня острого стресса, посмотрели. А дальше — три недели, и потом еще месяц, когда они отдыхали, а гиппокамп-то, оказывается, не отдохнул.
Два крысиных инсульта
А моделирование инсульта — это наука. Золотой стандарт у крыс — заткнуть среднюю мозговую артерию филаментом. Можно временно, можно перманентно. Сразу появляются неврологические дефициты, правда, в отличие от человека, через две недели они исчезают, но все равно видно. И мы тоже эту модель использовали. Надо сказать, с конца восьмидесятых — начала девяностых годов существуют две модификации модели. Была группа Коизуми в Японии, она первая ее очень хорошо описала и валидизировала. Потом возникла группа Лонга, которая ее немножко модифицировала. И с тех пор пошло: людям нужно испытать препараты, это им удобнее по Коизуми, они сделали по Коизуми; другим удобнее по Лонга — сделали по Лонга. Дальше исследуют патогенез, молекулярные механизмы — эти по Коизуми, эти по Лонга — и сравнивают их между собой.
И вот смотрите: за последние сорок лет ни один препарат-нейропротектор из нескольких десятков, которые показали перспективы в эксперименте, не преодолел испытания в клинике! Значит, модели почему-то не работают. Когда мы на крысах исследовали нейровоспаление, вот эту гипоталамо-гипофизарно-надпочечниковую систему, что с ней творится при инсульте, — мы это делали по Коизуми и, естественно, смотрели на гиппокамп. Получили хорошие данные, но мало, поэтому напечатали кратко в нашей «Нейрохимии». А потом, — я говорю, — ребята, давайте на большом числе животных сделаем. Сделали. А ни черта не воспроизводится! Как так? Все нормально со статистикой, животные из того же питомника. Садимся, делаем разборку. И выясняется, что нашим сказали в соседнем институте: «А у нас модифицированная модель Лонга, они все равно одинаковые, но у нас крысы так не мрут». И ребята воспроизвели вторую модель и получили совсем другие данные. У меня была траурная неделя, думаю: все, атас, надо уходить. А потом села с этими данными, сравнила, и вдруг поняла, что это разные модели. Изменения действительно минимальные по тому, как вводится филамент, но одна маленькая артерия не блокируется. Оказывается, мы в подарок из-за собственного раздолбайства получили две модели. На модели Коизуми мы видим активацию гипоталамо-гипофизарно-надпочечниковой системы, высокий кортикостерон и аккумуляцию кортикостерона и интерлейкинов в гиппокампе и фронтальной коре. А в модели Лонга этого нет, и через три месяца вообще все чисто! То есть мы смоделировали две клинические ситуации. «Когда б вы знали, из какого сора». Откуда берется удача в науке? Берется она исключительно из раздолбайства.
Стоп-стоп, Наталия Валерьевна… Почему это так важно?
Это говорит о том, что практически уже на уровне моделей некорректно исследования проводятся. Вы транслируете в клинику, а что вы будете транслировать, если вы считаете, что это одна и та же модель, а они разные?
Ну хоть что-то в клинике получается? С препаратами?
Есть голландская школа, те люди, которые внесли особый вклад в исследование глюкокортикоидов вообще и их рецепторов, в частичности в мозге — это Де Клот и его команда из Голландии, они сейчас уже насинтезировали довольно много препаратов, которые снижают действие глюкокортикоидов. Наверное, можно патенты посмотреть, но у меня пока не дошли руки. Вместе с тем я уже видела несколько статей, когда такого рода препараты дают вместе с антидепрессантами и показывают, что у них есть свой антидепрессивный эффект.
То есть это тоже косвенно подтверждает вашу гипотезу о поражении глюкокортикоидами…
Давайте представим себе, что есть такая сфера, и внутри этой сферы несколько разных механизмов — нейровоспаления, нарушения нейрогенеза, истощения трофических факторов, нейродегенерации, окислительный стресс, нитрозативный стресс, глутаматергическая трансмиссия. А вокруг этой сферы — гипоталамо-гипофизарно-надпочечниковое звено, вместе с гиппокампом, который как бы окружает эти механизмы, и каждый из этих механизмов связан с каждым из других. И чем больше вы будете выводить из строя гиппокамп, тем больше у вас будет ухудшаться регуляция. Вот как это устроено примерно, в моем понимании.
Эта стресс-реализующая система — она глобальная, она неспецифична, но в каждом данном участочке мозга или тела человеческого, в специфическом органе она становится специфичной. Я думаю, что нужно этой системой заниматься, и это более перспективно, чем искать специфические мишени и специфические средства для каждой патологии. Может быть, если вы уберете основу, у вас и с другими патологиями будет лучше, понимаете?
Не страшно было предъявлять гипотезу на суд научного сообщества? Или в нейрофизиологии так принято?
Помните, как называлась статья Толстого о смертной казни? «Не могу молчать». Я понимаю, что что-то может не подтвердиться, на то она и рабочая гипотеза. Но общий концепт нужно сформулировать так: «дистантное повреждение гиппокампа как основа коморбидности заболеваний мозга».
Вы на вопрос…
Да, сейчас. Нет, публиковать гипотезы принято у теоретиков, у экспериментаторов, к каковым я себя отношу, это менее принято. Но знаете, почему не страшно? Потому что если не опубликуешь — себя не заставишь дальше работать. Это немножко палка-погонялка. И очень хочется критику получить.
То есть вы ее даже приветствуете, если вас ругать начнут?
Ну конечно, мне же не шашечки, мне же ехать.


 Меню
Меню





 Все темы
Все темы




 0
0