Сбросить иммунную память, продлить жизнь
Как работает иммунопрофилирование, чему мы можем научиться у подземных жителей и почему нужно сбросить иммунную память, чтобы жить дольше и лучше? Об этом наш разговор с Дмитрием Чудаковым.

Дмитрий Михайлович Чудаков — директор Института трансляционной медицины РНИМУ им. Н.И. Пирогова, заведующий отделом адаптивного иммунитета в Институте биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова, профессор Сколковского института науки и технологий.
.
«Хочу, чтобы то, что мы делаем, где-то пригождалось»
Дмитрий, вы считаетесь самым цитируемым молодым биологом в нашей стране. Вас позиционируют как иммунолога. Но, насколько я знаю, в иммунологию вы пришли далеко не сразу.
Честно скажу, исходно иммунологию я знал очень плохо, в университете не воспользовался возможностью погрузиться в эту науку как следует. С 2000 по 2009 год я занимался исключительно разработкой и исследованием флуоресцентных белков. Но это был очень многогранный опыт. Это красиво — ты почти физически видишь, как аминокислоты в молекуле белка поворачиваются и взаимодействуют, и это завораживает.
Суть нашей работы состояла в том, чтобы понять, как хромофор флуоресцентного белка — та его часть, которая отвечает за цвет и флуоресценцию — созревает и функционирует, взаимодействуя с аминокислотами в своем окружении. Когда ты работаешь с этим, ведешь несложные генные модификации, чуть меняешь последовательность нуклеотидов, и у тебя на чашке вырастают бактерии, которые теперь продуцируют белок другого цвета или много разноцветных вариантов с разными свойствами, если делаешь библиотеку вариантов. Возникает удивительное чувство — будто ты руками потрогал молекулу. В этом смысле флуоресцентные белки совершенно уникальные, ты видишь связку между генными манипуляциями и фенотипом в самом простом и ярком выражении.
Какая у вас была тема?
Фотоактивируемые белки, в которых этот хромофор под воздействием света определенной длины волны еще и поворачивается, обратимо или необратимо меняет свойства — цвет, флуоресценцию. Включаются-выключается. Это была безумно интересная работа. При этом я никогда не был «белковиком» — с самого начала мне было интересно работать с ДНК, с библиотеками последовательностей и вариантов. Когда шла работа по флуоресцентным белкам, мне тоже нравилось придумывать, как с ДНК можно поиграть. Это потом очень пригодилось и в иммунологии.
Окружение, в котором я вырос — в лаборатории сначала у Сергея, а потом Константина Лукьянова — это сильнейший коллектив в стране, который тогда разрабатывал самые передовые и классные ДНК-технологии. Там было кого послушать и чему поучиться.
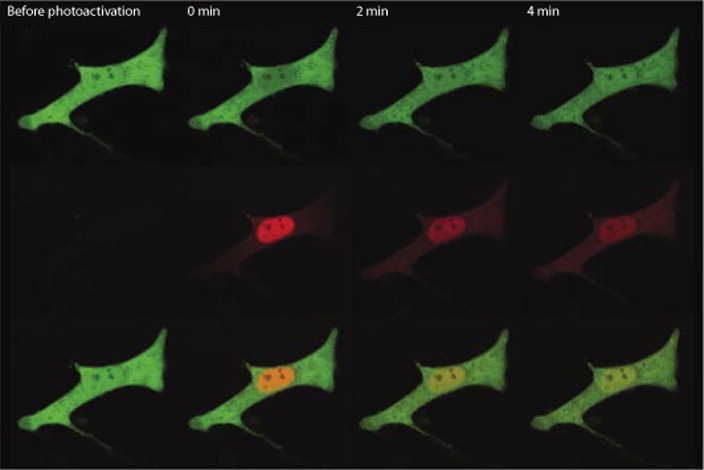 Белок Dendra2 при фотоактивации превращается из зеленого в красный. Затем можно наблюдать его перемещения в клетке. Credit: Biotechniques, 2007, DOI: 10.2144/000112470
Белок Dendra2 при фотоактивации превращается из зеленого в красный. Затем можно наблюдать его перемещения в клетке. Credit: Biotechniques, 2007, DOI: 10.2144/000112470
Мы работали с мономеризацией флуоресцентных белков, которые любят образовывать димеры, тетрамеры, что плохо для их практического применения в разных медицинских исследованиях, где часто требуются мономерные белки. Мы разрушали эти интерфейсы, белки портились, мы их как-то восстанавливали… Это тоже дало мне возможность почувствовать, как белки взаимодействуют, аминокислоты «толкаются». В сегодняшнем моем мире это взаимодействие Т-клеточного рецептора с антигенпрезентирующим комплексом и пептидом, который на нем представлен. Это сложная многоуровневая биоинформатика, для понимания которой мне не хватает математического бэкграунда. Но на уровне ощущений, ручного понимания мне это все очень близко, и это идет от предыдущего опыта.
Почему же вы перестали заниматься флуоресцентными белками?
Я думаю, что всегда примерно понимал, что не хочу всю жизнь заниматься этой темой. Она увлекательна, но происходит в довольно замкнутом контуре. И в какой-то момент она более-менее исчерпала себя с точки зрения каких-то полезных инструментов, которые я способен разработать. Я не совсем ученый, а скорее инженер.
Впервые вижу известного ученого, который говорит, что он не совсем ученый.
Я говорю про мотивацию. Нет, мне интересно, конечно, как все устроено фундаментально, но все-таки я хочу, чтобы то, что мы делаем, где-то пригождалось. Те же флуоресцентные белки, которые мы разработали, широко используются в разных научных и биомедицинских исследованиях. Сейчас развитие продолжается, есть бесчисленные варианты сенсоров, удивительные вещи делает Всеволод Белоусов с оптогенетикой, Константин Лукьянов тоже успешно продолжает это направление.
Флуоресцентные белки для вас себя исчерпали. А иммунология неисчерпаема?
Наука вообще, конечно, неисчерпаема. Но, видимо, у каждого человека есть период активного творчества в какой-то области, и он заканчивается. В иммунологии это тоже, может быть, произойдет, но я не знаю, сколько времени мы будем приносить тут пользу.
ПЦР, сто монахов и баркодирование
Поговорим о методах, описываемых в ваших работах. Что такое, например, метод MIGEC, или molecular identifier groups-based error correction? Какие ошибки он исправляет?
Есть в работе с библиотеками ДНК очень мощный инструмент, который называется «молекулярное баркодирование». Не мы это придумали, одним из первых эту идею предложил Берт Фогельштейн, американский ученый-онколог, пионер в области геномики рака. Однако мы были первыми, кто применил эту технологию для анализа репертуаров Т-клеточных рецепторов и антител и показал, что этот подход дает решающие преимущества.
Например, у вас на старте ограниченное количество материала — а это почти всегда так — и вы хотите как-то размножить молекулы ДНК/РНК и потом прочитать. Сегодня с помощью массивного секвенирования вы можете получить миллионы прочтений и надежно увидеть, что за последовательности у вас в исходном материале. Но пока вы размножаете эти молекулы, вы накапливаете огромное количество ошибок. И дальше оказывается, что вы не знаете, видите ли вы сейчас настоящее разнообразие или анализируете ошибки, которые накопились, пока вы готовили эту библиотеку.
И тогда было придумано следующее (повторюсь, не нами): на старте в самом начале вы можете каждой молекуле «пришить» уникальный молекулярный идентификатор — последовательность нуклеотидов, то есть какие-то конкретные уникальные «слова». Потом вы эту молекулу размножили в ходе полимеразной цепной реакции, отсеквенировали. И тут оказывается, что у вас есть тысяча прочтений, но вы знаете, что все они относятся к одной и той же стартовой молекуле, потому что висит одинаковая метка, которую вы «пришили» в самом начале. В метке тоже могут происходить ошибки, но их можно корректировать. И получается, что вы усредняете эту информацию.
По этому поводу вы приводите пример с машинистками, которые одновременно очень быстро печатают один и тот же текст на непонятном им языке. Этот метод позволяет отличить ошибки, которые они сделали, от тех ошибок, которые были в исходном тексте?
Или, например, какое-то древнее издание Библии, и монахи в разных монастырях все время переписывали этот текст. Из ста монастырей собрали эти тексты, а они разные. Как это возможно? Дело в том, что накопились ошибки, пока их переписывали. Но если вы уверены, что все это — копии одного исходника, то вы можете понять, усреднив эту информацию, где настоящий исходный текст, вычислить его. В одном монастыре сделали одну ошибку, в другом другую, в третьем — третью. Не может быть, чтобы все сделали одинаковые ошибки. И когда вы объединяете эту информацию, то можете надежно вычислить реальный первоисточник.
То же самое и здесь: вы устанавливаете исходную последовательность нуклеотидов. Это работает, например, в диагностике рака, когда вам нужно поймать редкую мутацию в образце, и вы хотите быть уверенным, что она там действительно есть.
Именно для этого нужен такой метод? Чтобы потом, используя его, понять, как правильно лечить тот же рак?
И не только. Вторая вещь, которую он нам дает, — вы начинаете видеть, с каким количеством стартовых молекул работаете. Потому что вы каждую пометили и теперь можете посчитать, сколько у вас таких уникальных идентификаторов — тысяча, десять тысяч? Это позволяет вам очень аккуратно нормировать и сравнивать образцы, когда вы пытаетесь судить о разнообразии вариантов в репертуаре иммунных рецепторов. То, что вы можете считать молекулы, тоже важно.
Почему это важно в иммунологии?
Потому что в разнообразии вариантов иммунных рецепторов, Т-клеточных рецепторов или антител встречаются очень похожие последовательности. В случае Т-клеточных рецепторов это так называемые публичные варианты, которые в каждом из нас образуются похожие и часто. Они выполняют полуврожденные функции. Или, например, пришла инфекция, на нее идет ответ. Но в ответ на конкретный антиген образуется не один вариант лимфоцитов, а несколько клонов. В них могут быть похожие последовательности Т-клеточных рецепторов, потому что они узнают одно и то же, поверхности им нужны одинаковые. Это важно: в мире Т-клеточных рецепторов бывают похожие варианты, которые распознают один и тот же антиген. Но вы хотите быть уверенным, что это настоящая группа похожих вариантов, а не продукт накопленных ошибок.
 Рецепторы на поверхности Т-клетки. Credit: 123rf.com
Рецепторы на поверхности Т-клетки. Credit: 123rf.com
В случае антител это тем более важно, потому что В-лимфоциты умеют делать следующую вещь: если В-лимфоцит, который может производить подходящее антитело, нашелся удачно, то дальше иммунная система начинает его улучшать, вносить в него случайные мутации и отбирать варианты антител, которые лучше распознают этот антиген. По сути, в такой структуре в ходе созревания антител накапливаются ошибки, которые оказались удачно ошибочными. И архитектура накопления этих ошибок практически такая же, как в том случае, когда вы готовите образец, размножаете молекулы и накапливаете свои искусственные ошибки.
И вот вы хотите посмотреть, как эволюционировали антитела в модели, а у вас поверх наложено дерево ошибок, плодившихся в ходе размножения молекул. Вы не можете отличить одно от другого, они смешиваются в кучу. Поэтому если вы хотите посмотреть глубокий репертуар антител и построить настоящее дерево с разветвляющимися иммуноглобулинами, вам нужны эти молекулярные идентификаторы, чтобы уничтожить ошибки ПЦР и секвенирования.
Вы научились различать эти варианты?
Да. В этой конкретной области мы не изобретали уникальные молекулярные идентификаторы, но мы разработали подходы, алгоритмы и, я думаю, в целом довольно серьезно продвинули это поле вперед.
Архитектура иммунного ответа
Эти методы уже где-то применяются или пока остаются в лаборатории? Например, можно ли с их помощью определить иммунный ответ пациента на вакцинацию от COVID?
Это довольно сложная задача, мы ею сейчас занимаемся. Но в целом эти методы используются очень интенсивно, сегодня это инструмент разработки самых разных иммунотерапевтических подходов, анализа действия вакцин, и в ближайшем будущем на основе анализа иммунных репертуаров, видимо, будет активно развиваться диагностика разных заболеваний. Ведь иммунная система реагирует на инфекцию, вакцину, взаимодействие с микробиотой, на аутоиммунные процессы, онкологические — на все реагирует и все запоминает. Это потенциально читаемая информация, хотя и очень сложная.
Что значит «реагирует» в случае иммунной системы?
Она находит варианты Т-лимфоцитов, которые распознают какой-то антиген, выбирают на основе входящей информации, каким образом и где нужно будет работать, размножаются, и вы получаете клональные экспансии — размноженные Т-клетки с определенным вариантом Т-клеточных рецепторов и определенными программами действий. Они размножаются в тот момент, когда иммунная система реагирует на антигены, и дальше остаются в виде клеток памяти. Многие остаются надолго, даже на всю жизнь с нами.
Получается, что внутри находится информация о том, чем вы болели, какие были вакцины, какие у вас сейчас проблемы. Мы пока что эту информацию, это разнообразие вариантов Т-клеточных рецепторов умеем читать очень плохо.
А было бы пределом мечтаний прийти в поликлинику, сдать анализы и сразу узнать, какой Т-клеточный иммунитет у нас выработался, на какие виды возбудителей, что требуется профилактировать, а что не нужно.
Это даже более серьезная вещь. Это молекулярная диагностика реальной первопричины аутоиммунных заболеваний, реальных ответов на опухолевые клетки. Не просто диагностика, а будущие ключи к детализированной терапии для каждого пациента.
Они появятся в массовом здравоохранении?
Обязательно, но не сразу. Это непросто. Мы все очень разные, существует огромное разнообразие этих репертуаров, десятки миллиардов вариантов. А еще у нас разные HLA-контексты, или антигенпрезентирующие молекулы, которые по-разному представляют нашим Т-клеткам антигены, и это тоже сильно усложняет дело.
Разработка терапевтических антител, которые сейчас используются при COVID, ведется этими же методами?
Да, как и разработка терапевтических вариантов Т-клеточных рецепторов. Системы скрининга во всех фармах в этих процессах сегодня используют репертуары иммунных рецепторов.
Или, например, вы хотите сравнить, как сработали разные типы иммунотерапии, чтобы вызвать ответ против опухоли. Сравниваете их сначала на модельных животных, а потом в клинических исследованиях на пациентах. Вам нужно видеть, как отвечают пациенты, много ли размножается Т-клеток, каких именно.
Или вы хотите понять, кому из пациентов поможет иммунотерапия, а кому нет. Вы берете образцы опухоли и смотрите, чем они отличаются, ответили или не ответили они на терапию. В том числе важными оказываются параметры, связанные с архитектурой репертуара Т- и В-лимфоцитов непосредственно в опухоли. Это исследование тоже относится к иммунопрофилированию.
Сейчас уже делается, в частности, в онкоцентре на Каширке, иммуногенетическое исследование опухолевых тканей пациентов, чтобы подобрать адекватную терапию. Это что-то родственное вашим методам?
Скорее всего, речь идет о иммуногистохимическом анализе, когда смотрят наличие на поверхности иммунных клеток белка, на который непосредственно воздействует иммунотерапия. В массе иммунных клеток вы можете посмотреть уровень экспрессии в целом, что называется, среднюю температуру по больнице.
В реальности ключевые роли играют иногда очень маленькие клональные популяции. Например, в опухоль приходит большое число Т-лимфоцитов. Но бо́льшая их часть не имеет отношения к противоопухолевому ответу. Важно, что среди них есть Т-клетки, которые знают, что делать, — они распознают опухолевые антигены и могут атаковать, блокировать или отвлекать иммунную систему, если она запуталась и приняла неверные решения. Это могут быть малые доли процента от всех Т-лимфоцитов. И в таком поверхностном анализе вы не можете их идентифицировать и что-то конкретное понять.
В нашем случае вы смотрите на архитектуру репертуаров, идентифицируете их, и это может вам гораздо больше сказать о том, что иммунная система в действительности собирается сделать. Это как если вы смотрите на толпу людей и не знаете, есть ли там человек, который знает, что делать. Конечно, вы можете посмотреть их рост, какого цвета у них куртки или глаза, но представьте себе, что вы с каждым провели интервью по интересующему вас вопросу и поняли, что, оказывается, вот эти четыре человека что-то понимают и знают. Именно они могут предложить хорошее решение.
Правильно ли я понимаю, что эти методики можно использовать для ранней диагностики, в том числе онкологических и аутоиммунных заболеваний или даже предрасположенности к ним, чтобы их предотвратить?
Да. В аутоиммунных заболеваниях это совершенно точно так, и это можно использовать. Есть американская компания Adaptive Biotechnologies, наш большой конкурент, и пару лет назад они публично объявили, что договорились с компаниями Microsoft и Genentech объединить усилия, чтобы разрабатывать такую диагностику. Это, правда, гораздо сложнее сделать, чем объявить. Сейчас в Америке одобрен первый тест по репертуару Т-клеточных рецепторов. Они утверждают, что могут понять по репертуару, кто переболел ковидом, а кто нет. (Об этом Adaptive рассказывала на JPM-2022. — PCR.NEWS.)
В реальной жизни — мы посмотрели их данные и поняли, что они немного поторопились со своими заявлениями, там все сложнее, есть прямые ошибки. Но это не значит, что эта технология не может работать. Нам только нужно научиться верно анализировать информацию, интерпретировать ее.
В аутоиммунных заболеваниях смысл будет в том, чтобы по возможности на ранних стадиях увидеть конкретные клоны Т-лимфоцитов, которые вовлечены в развитие заболевания. Это позволит быть более уверенными в диагнозе, гораздо лучше классифицировать варианты заболевания, потому что они все по разным дорожкам развиваются — рассеянный склероз или диабет первого типа. Вы увидите эти дорожки.
Следующий уровень — если вы знаете, что является причиной, то у вас появляется желание разрабатывать технологии прицельного уничтожения конкретных аутоиммунных популяций Т-лимфоцитов. Именно такую работу мы сейчас ведем совместно с компанией «Биокад» по болезни Бехтерева, и это совершенно пионерская штука.
А в случае онкологии обратная задача: найти хорошие варианты, которые позволят нам атаковать опухоль, или подавить конкретные варианты регуляторных Т-лимфоцитов, которые не дают атаковать опухоль.
Слепой глухой долгожитель с короткой памятью
Давайте обсудим вашу работу, посвященную слепышам. Раньше я об этих животных даже не слышала. Между тем это удивительные организмы. Без глаз, без ушей, но при этом долгожители, устойчивы к раку. Как им это удается?
Это очень смешные звери, довольно хитрые. У них практически невозможно взять кровь, что затрудняет их изучение: у них низкое давление.
Низкое давление — один из факторов долгожительства?
Не знаю, думаю, что нет. Понятно, что разных адаптаций может быть много, и во всей сложности устройство этого зверя мы еще не скоро разберемся. Но мы увидели удивительную вещь, которая дала возможность по-другому взглянуть на адаптивный иммунитет.
 Spalax zemni. Credit: fringilla | 123rf.com
Spalax zemni. Credit: fringilla | 123rf.com
Эти звери действительно очень редко болеют онкологическими заболеваниями, у них очень низкий статус воспаления. И с виду они особо не стареют. В чем красота с точки зрения иммунной системы — мы увидели, что у них с возрастом не накапливается крупных клональных экспансий, популяций клеток памяти. У нас с вами, как мы только что говорили, они накапливаются с возрастом, мы «помним», от чего нас вакцинировали, чем мы болели. Это хорошо, мы защищены от повторного заболевания той же инфекцией в тяжелой форме, и это наше преимущество. Но они накапливаются, занимают все больше места в гомеостазе. При этом число Т-лимфоцитов ограничено.
Наверное, еще и этим можно объяснить, что у пожилых людей после вакцинации далеко не всегда вырабатываются антитела?
Эффективность вакцинации с возрастом действительно снижается, но я не могу сказать, что мы хорошо понимаем, почему именно. В частности — да, одной из причин может быть груз ранее принятых решений, среди которых новым Т- и В-лимфоцитам приходится пробивать себе дорогу и доказывать, что они тоже нужны.
То же самое и у мышей — хотя они живут всего два года, но успевают накопить клональные экспансии, и мы это видим по архитектуре репертуара: разнообразие падает, а крупные клоны растут. А у слепыша такого с возрастом не происходит. У зверей одного года и восемнадцати лет одинаковое разнообразие. Почему — вопрос пока открытый.
Каким образом вы вышли на этот объект?
Мы хотели добыть голых землекопов. Но молодых голых землекопов еще можно добыть, а пожилых очень трудно. Вы не можете поймать его в поле и утверждать, что это пожилой землекоп. Он выглядит молодо, паспорта нет. Получается, что они должны быть задокументированы, жить в лаборатории или быть окольцованными. Люди, которые ими занимаются, каждым экземпляром дорожат. Делиться с нами просто отказались.
Но нам повезло найти другого долгоживущего зверя в Израиле. Они довольно далекие родственники, но с большой вероятностью в их эволюции произошли независимые похожие события. Думаю, у голых землекопов может оказаться такая же история с отсутствием долгой клональной памяти иммунных клеток.
Почему такое большое преимущество может давать отсутствие долговременной иммунной памяти?
Ключ здесь, наверное, в следующем: иммунная система за нашу жизнь принимает очень много решений и запоминает их. Аутоиммунные заболевания — это ситуация, при которой иммунная система приняла ошибочное решение атаковать собственные ткани, запомнила его и воспроизводит. В человеческих социумах тоже так бывает.
Конечно, иммунная система устроена так, что ошибается крайне редко и в целом делает все правильно, но если она ошиблась и запомнила свою ошибку, то это проблема.
В ходе эволюции опухоли и ее взаимодействия с иммунной системой могут возникать клональные популяции памяти иммунных клеток, которые что-то делают, но делают не то. Они решили опухоль не атаковать либо вызывать вокруг воспаление, но не таким способом, который позволяет уничтожать опухолевые клетки.
Тут весь фокус в том, что есть разные типы иммунного ответа. Иммунная система принимает решение не просто отвечать или не отвечать — она каждый раз выбирает особенную дорожку: на этот тип угрозы мы отвечаем так, а на этот иначе. На вирус, бактерию, гельминт мы ответим совершенно по-разному. По этой причине и неудачная вакцина — например белковая или пептидная вакцина против вирусов в отсутствие нужных адъювантов — может не только не защищать, но и приводить к более тяжелому течению заболевания. Потому что иммунная система отвечает, но не так, как нужно, и это ухудшает ситуацию.
Но аутоиммунные заболевания, онкология — это крайние примеры ошибок иммунной системы. Может быть хроническое воспаление, атака на наши собственные или пищевые антигены, на нормальную микробиоту, может быть неоптимальный выбор типа ответа на хроническую вирусную инфекцию и так далее. Таких небольших ошибок накапливается очень много. Иммунная система за нашу жизнь приняла миллион таких решений и сто раз ошиблась. Возникло сто клонов в разных местах нашего тела, они что-то делают и постоянно или периодически делают не то.
Т-лимфоциты, чтобы хорошо выполнять свою работу, должны быть очень самоуверенными: «Мы знаем, что делать, мы уже видели этот антиген, сейчас мы тут устроим цитотоксический ответ», — говорят они. И они не только атакуют сами, но и настраивают иммунные и неиммунные клетки вокруг на определенные программы. Эти клональные популяции инициируют разного рода хронические воспаления — разные по своему типу, разной локализации, в разных тканях.
С нашей точки зрения, накопленные ошибки адаптивного иммунитета — это самое понятное и логичное объяснение того, что называется в англоязычной литературе inflamm-aging — нарастающее с возрастом состояние воспаления, которое может служить нишей для развития в том числе онкологических заболеваний и просто для истощения локального пула стволовых клеток. А дальше — где тонко, там и рвется.
Это у нас. А у слепышей иначе?
Да, у них с возрастом таких самоуверенных, уперто делающих свою работу крупных клонов, особенно цитотоксических клонов Т-лимфоцитов, не накапливается. Или гораздо меньше накапливается, мы не видим их в архитектуре репертуара. И эта «незлопамятность», как нам кажется, может объяснять ненакопление воспалений с возрастом.
Что эта информация нам дает?
Это позволяет по-другому взглянуть на причины огромного количества разных заболеваний, в том числе возрастных. Ведь основные причины нашей смертности — онкология, инфекционные заболевания, те же «неверные», чрезмерные ответы на COVID. Основная до недавнего времени причина смертности в нашей стране — кардиоваскулярная — тоже имеет отношение к иммунной системе. Потому что мягкая бляшка, которая может разорваться и закупорить сосуд, это, по сути, локальная воспалительная ниша, она инфильтрирована лимфоцитами. Это можно — с разными оговорками — называть неким типом вялотекущего аутоиммунного процесса, который опять же завязан на память иммунных клеток.
Переселимся под землю?
Связано ли долгожительство с подземным образом жизни? Может, человечеству тоже надо туда, подальше от радиоактивного солнца?
Я бы не стал грешить на радиацию. Есть более понятное объяснение: они живут маленькими колониями на больших территориях, не кучно, мало обмениваются инфекциями и, возможно, поэтому могут себе позволить не иметь долговременной памяти. Для меня это объяснение не вполне убедительное: многие ведут похожий образ жизни, но не живут по 20–40 лет при таких небольших размерах.
Есть разные гипотезы. Одна из них зацеплена на ретроэлементы, а это тоже такая часть нашего существа, которая связана с функционированием и эволюцией иммунной системы. Это подвижные элементы генома, которые у слепышей, кажется, давно перестали скакать. Мы точно не знаем, как это у них вышло. Сочетание каких-то факторов совпало, в какой-то момент что-то «сломалось» и в их памяти адаптивного иммунитета относительно обычных млекопитающих, которых мы знаем.
Изучают ли слепышей еще какие-то научные группы?
Именно слепышей изучают немногие. Таких слепышей, как у нас, изучают еще в Израиле, но они больше заинтересованы в особенностях врожденного иммунитета. Поэтому прямой конкуренции пока мы не видим. Но, конечно, будут работы по голому землекопу, поглядим.
Ведется много разговоров о том, чтобы научиться долгожительству у голого землекопа. Но пока что не удалось даже выяснить, как ему самому это удается, не говоря о том, чтобы это свойство у него перенять. Может быть, со слепышом вам повезет больше?
Перенять это свойство будет сложно, потому что у них это не просто случилось однажды в эволюции — они еще полностью перестроились под это свое свойство. Но тем не менее этот угол зрения интересен. Люди и раньше предполагали, что, возможно, есть какой-то способ аккуратно «сбросить» иммунную память ближе к пожилому возрасту, чтобы продлить если не жизнь, то активное долголетие. А в конечном счете именно жизнь, потому что если вы снимаете хроническое воспаление, то ликвидируете причины для развития онкологических и кардиоваскулярных заболеваний.
Каким образом можно это сделать?
Отчасти его можно аккуратно снимать системно — иммуносупрессивными препаратами ревматологического спектра. Это моноклональные антитела, которые сейчас используются и при COVID. Может быть, удастся подобрать какие-то мягкие варианты с минимальными побочными реакциями. Однако это все равно грубое подавление. Не так должна выглядеть иммунотерапия будущего.
А как она должна выглядеть?
Возвращаясь к истории с аутоиммунными заболеваниями, если мы видим, что в организме пациента нарастают клоны Т-лимфоцитов, которые нам не нравятся, могут быть разработаны новые технологии, чтобы их избирательно подавить. Это будет более-менее упреждающая иммунотерапия. Как я уже говорил, по болезни Бехтерева у нас идет большая работа с компанией «Биокад». В этом году должна стартовать вторая фаза клинических испытаний.
А если учиться у слепыша или голого землекопа, то из того, что мы на сегодня поняли, — видимо, нужно пытаться до некоторой степени сбросить иммунную память. Мы говорим иммунной системе: надо забыть, что было раньше. Это тоже несет в себе определенные риски, и неизвестно, как это на нас с вами отразится.
«Надо взвешивать риски»
Вы много писали о COVID. Как вы думаете, почему прививочная кампания в нашей стране провалилась? Откуда этот социальный феномен?
Я бы не сказал, что она провалилась. Во многих смыслах нам повезло: «Спутник» – удачная вакцина. За ней стояла серьезная история, платформа была проверена, ее не «c колес» пустили в массы. Но нужно было, наверное, провести более серьезную работу, объясняющую предысторию, показать историю вакцины от Эболы, которая делалась на той же платформе. Объяснить, что людей вакцинировали и никаких ужасных побочек не было.
 Очередь к на бесплатную вакцинацию. Москва, июнь 2021 года. Credit: 123rf.com
Очередь к на бесплатную вакцинацию. Москва, июнь 2021 года. Credit: 123rf.com
Проблема еще и в том, что нам не хватило физических мощностей, чтобы быстро масштабировать производство. Низкие темпы вакцинирования были связаны не только с тем, что люди отказывались, но и с тем, что было нечем. Государству просто не удалось быстро произвести достаточное количество вакцин. Если бы с этой задачей могли справиться, то, я думаю, возникли бы способы убедить людей, заставить, мотивировать финансово.
Заставить или убедить?
Где-то заставить, где-то убедить, где-то заплатить. Ковид — это заболевание с очень высокими рисками для жизни, и в этот момент применение вакцин, которые защищают, было точно оправданно, даже с оговоркой, что ни для аденовирусных вакцин, ни для мРНК вакцин большой истории на широкой популяции до сих пор не было.
Но при этом мне кажется, что нужно быть осторожными и не торопиться навязывать населению мысль о необходимости колоть каждый год сильнодействующую вакцину. Я не уверен, что это разумно. Тем более, вирус быстро эволюционирует. Он практически полностью ушел от нейтрализующего воздействия ранее выработанных антител, и от инфекции вакцина нас сейчас защитить практически ничто не может. Мы можем сделать новую вакцину против действующего штамма, но мы уже точно знаем, что он уйдет и от нее. При этом я осторожно надеюсь, что сейчас системный популяционный Т-клеточный ответ, как и антительный, локальный, придет к тому, что в существенной степени это заболевание затихнет.
Несмотря на вакцинацию и ревакцинацию, люди заболевают, причем неоднократно. Это потому, что на каждый штамм требуется новая вакцина? Но почему тогда академик Гинцбург заявляет, что и на этот штамм вакцина будет эффективна?
Давайте попытаемся развести два разных следствия применения вакцины. Мы ждем защиты от факта инфекции или от тяжелого течения заболевания? От инфекции защищают только очень высокие титры антител, даже сильнодействующий Pfizer придется колоть раз в три месяца, и непонятно, в какой момент это истощит иммунную систему. Но это не то, к чему нужно стремиться. И Pfizer, и «Спутник» дают Т-клеточный ответ против разных, в том числе консервативных эпитопов. Они дают ответ правильного типа — первый тип иммунного ответа, который нужен для защиты от вирусных заболеваний. И если вакцинированные люди болеют ковидом, это совсем не та степень тяжести, как они болели бы без вакцинации. Вся информация на сегодняшний день показывает, что люди, привитые правильными вакцинами, болели легче и выздоравливали быстрее. Я думаю, что это в первую очередь связано с наличием Т-клеточного ответа, Т-клеточной памяти. В этом смысле вакцины, в том числе «Спутник», по-прежнему оправданны.
Но, глядя в будущее, повторюсь: надо не безумствовать и взвешивать риски. Массовое применение сильнодействующих вакцин, не до конца проверенных временем, — это более серьезное воздействие, чем большая часть вакцин, которые мы применяли раньше. Это было необходимо, но выходить на ежегодную вакцинацию «Спутником», чтобы защититься от омикрона или другого штамма, наверное, не следует. Вакцина — это классное изобретение, это безусловное добро. Но в то же время нам нужно изучать долгосрочные последствия сильнодействующих вакцин. Другое дело, что наши надежды могут не оправдаться и вирус опять может качнуться в другую сторону. Через год, возможно, придет более тяжелый вариант.
«Хочу работать в России»
Как вы оцениваете состояние науки в России? Видите ли вы здесь перспективы? Были ли у вас предложения уехать в хорошую западную лабораторию?
Честно говоря, я ни с каким западным университетом до сих пор предложение уехать не обсуждал предметно. Не рассматривал для себя такую возможность. Я люблю жить в этой стране и, несмотря ни на что, упорно надеюсь, что мы сможем построить эффективное нормальное государство. Во всяком случае, отказываюсь признать, что у нас все будет плохо.
Сегодняшняя наука — это очень сложная и дорогая ткань. Она способна развиваться и существовать только при наличии критической массы — научных лабораторий, инфраструктуры, заводов, которые производят разные штуки, венчурных компаний, которые инвестируют и т.д. Конечно, центр этой критической массы находится сегодня в США. Еще в Германии, Великобритании и в Китае. Но насколько он будет открыт для взаимодействия с нами — это вопрос интересный.
Совершенно точно современную молекулярную медицину развивать в изолированном состоянии невозможно, у нас не хватит этой критической массы людей, компетенций, технологий, заводов, инвестиций. Но последние 10 лет тенденции были во многом позитивные. Много всего произошло. Компания «Биокад» запустила на наш рынок целый ряд довольно сложных иммунотерапевтических препаратов, моноклональных антител, они хорошо работают, помогают спасать жизнь, поднимают качество жизни.
Появилось много молодых ребят, которые хотят и могут что-то развивать, начали что-то делать на серьезном уровне. Десять лет назад наша лаборатория чувствовала себя немного одиноко в исследованиях иммунной системы, а сейчас я понимаю, что у меня есть с кем конкурировать. И это хорошо, конечно.
Отчасти это связано с тем, что определенное количество серьезного финансирования поступило, разные гранты появились. Сейчас назрела реформация, потому что и размер гранта уже не позволяет серьезно поддерживать научную группу. По этой же причине я бы не увлекался чрезмерно большими проектами, которые, конечно, нравятся высшим начальникам университетов. Вроде бы мне тоже должно нравиться, как директору института, но я вижу, что более эффективным и живым инструментом являются разумные гранты — не «мега», а среднего размера. Условно, 150 тысяч долларов в год на серьезный проект научной группы, на пять лет, с возможностью продления по результатам.
Как вы оцениваете Федеральную программу развития генетических технологий?
Финансов объективно стало больше в науке, государство инвестирует. Но эффективность и удобство их использования пока не очень растут. Нам по-прежнему не разрешено переносить средства на следующий год, при том, что приходят они далеко не в начале года.
Что это значит на практике?
Это значит, что под конец года мы, высунув языки, пытаемся потратить оставшиеся финансы, покупая, во-первых, дороже иногда, потому что компании-поставщики тоже используют этот момент, во-вторых, не совсем то, что мы хотели бы. У всех наших реагентов есть сроки годности. Мы не хотим покупать сейчас, мы хотим отложить эти деньги и купить через полгода.
И плюс защита от коррупции в виде тендеров дает иногда обратный эффект. Мы и так заточены на то, чтобы потратить свои деньги эффективно, мы и так с удовольствием купим там, где дешевле. Вот я покупаю центрифуги, и хочу центрифуги Eppendorf, потому что они хорошие. Но по параметрам подходят какие-то польские центрифуги, которые дешевле, и я обязан их купить. А я не хочу. В общем, то, что финансов стало больше — это хорошо, но удобство и разумное доверие сильным научным коллективам, которые их используют, здорово повысило бы эффективность.
Еще нужно отрабатывать правила взаимодействия ученого — института — государства — грантового агентства и внешних коммерческих компаний, налаживать правила игры по интеллектуальной собственности. Ученые не всегда понимают, что они могут сделать с тем, что они придумали, если они хотят пустить это в практику. Кажется, работа по законодательству ведется, и оно улучшается, но пока этих понятных правил все же нет.
Мы общаемся с вами в выходной день, вы находитесь в своей лаборатории. Вы там один, или вас таких много?
Кто хочет — конечно, работает. Это как спорт: если увлекся, уже не оторвешься.


 Меню
Меню





 Все темы
Все темы




 0
0