Активация макрофагов приводит к патологическому росту сосудов в сетчатке
Исследователи показали, что при гипоксии эндотелиальные клетки сетчатки выделяют лактат, который стимулирует гликолиз в окружающих макрофагах и микроглии. У них увеличивается количество ацетилированных гистонов в промоторах генов, отвечающих за активацию и синтез проангиогенных факторов. Макрофаги приобретают уникальный фенотип PRAGM и стимулируют усиленный ангиогенез. Эксперименты проведены на новорожденных мышатах и культурах клеток.
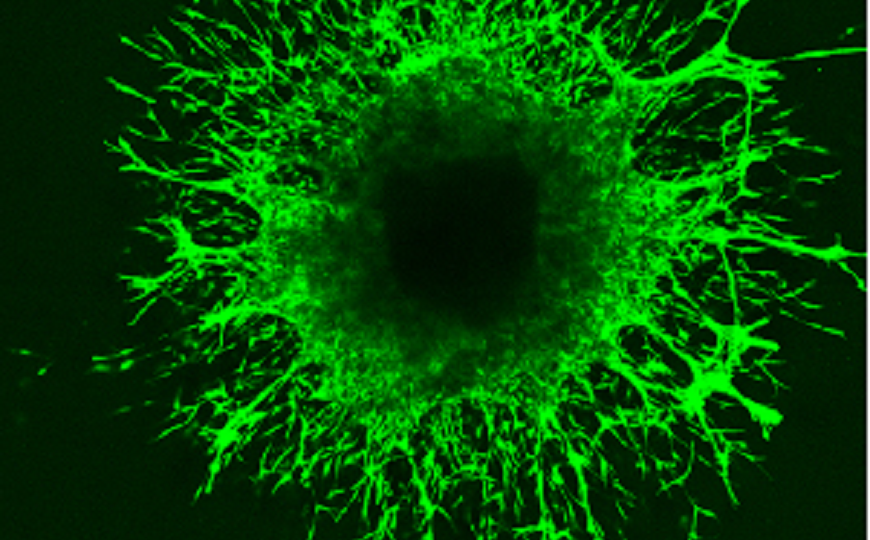
Прорастание кровеносных сосудов в экспланте. Совместное выращивание эндотелиальных клеток и макрофагов привело к максимальному росту сосудов.
Формирование сосудов происходит за счет ветвления и пролиферации эндотелиальных клеток. Ключевым фактором, способствующим ангиогенезу, является гликолиз. Иногда в сетчатке эти процессы нарушаются, например, из-за гипоксии, что приводит к патологическому разрастанию сосудов и необратимой слепоте. Известно, что макрофаги и микроглия также участвуют в патологическом ангиогенезе: например, опухоль-ассоциированные макрофаги выделяют ангиогенные факторы и способствуют росту опухоли. До сих пор не ясно, как метаболически связаны между собой эндотелиальные и миелоидные клетки в сетчатке, и что стимулирует в них гликолиз.
Группа исследователей из Китая и Америки изучила механизм «общения» макрофагов/микроглии и эндотелиальных клеток сетчатки (REC) и его влияние на ангиогенез. Основным объектом была сетчатка новорожденных мышат в норме и в случае кислород-индуцированной ретинопатии (OIR): через неделю после рождения животных на 5 суток помещали в среду, богатую кислородом, а после — назад в нормальную. В кислородной среде происходит сужение сосудов в сетчатке, что при возвращении в обычную среду (относительная гипоксия) провоцирует патологическое разрастание сосудов в сетчатке. Макрофаги и микроглия располагались вокруг растущих сосудов в норме и в патологических пучках при OIR.
Количественной ОТ-ПЦР авторы оценили экспрессию генов, кодирующих регуляторы и ферменты гликолиза, в клетках, выделенных из сетчатки с помощью лазерного микродиссектора. Экспрессия этих генов, в частности — гена Pfkfb3, кодирующего изофермент фосфофруктокиназы-2, была усилена в эндотелии и макрофагах/микроглии случае OIR.
Исследователи получили мышей с нокаутом Pfkfb3 в миелоидных клетках. При индукции OIR у мутантов площадь патологических неоваскулярных пучков была ниже, чем в контроле, как и проницаемость сосудов. Так, нарушение гликолиза у макрофагов останавливает патологический ангиогенез.
Далее in vitro авторы показали, что растворимые факторы, выделяемые эндотелиальными клетками при гипоксии, индуцируют гликолиз в миелоидных клетках. Основным фактором оказался лактат — продукт гликолиза в самих REC. Макрофаги при активации гликолиза приобретают уникальный смешанный фенотип, который исследователи назвали PRAGM (pathological retinal angiogenesis–associated glycolytic macrophages/microglia — гликолитические макрофаги/микроглия, связанные с патологическим ангиогенезом в сетчатке). Для подтверждения ангиогенного эффекта гликолиза макрофагов авторы выращивали REC в среде, полученной после культивирования активированных нормальных и мутантных по Pfkfb3 макрофагов. Пролиферация эндотелиальных клеток, соответственно, повышалась и понижалась в сравнении с контролем. Подобные результаты получили на двумерной и трехмерной моделях ангиогенеза in vitro, а также при анализе ветвления колец аорты и сосудов хориоидеи (сосудистой оболочки глаза) ex vivo. Приобретение фенотипа PRAGM и стимулирование ангиогенеза нарушалось при выключении транспортеров лактата.
Получается, что макрофаги и эндотелиоциты активируют друг друга. Это подтвердили, инкубируя эксплант аорты с макрофагами или со средой, полученной при их культивировании: в первом случае ветвление экспланта было сильнее. В эндотелии также наблюдали усиление экспрессии Pfkfb3.
После активации у макрофагов повышалось количество еще одного продукта гликолиза — ацетил-КоА. Он является субстратом для ацетилирования белков, и авторы наблюдали усиление ацетилирования гистонов у этих клеток и снижение — у мутантных по Pfkfb3. Они показали увеличение количества ацетилированных гистонов в промоторах генов, отвечающих за развитие фенотипа PRAGM.
Источник
Zhiping Liu et al. // Glycolysis links reciprocal activation of myeloid cells and endothelial cells in the retinal angiogenic niche // Science Translational Medicine, 2020; DOI: 10.1126/scitranslmed.aay1371


 Меню
Меню





 Все темы
Все темы




 0
0








