Бактериальный «шприц» для доставки белков в клетки человека
Бактерии-эндосимбионты используют сократительные инъекционные системы, чтобы вводить белки в клетку-хозяина. Ученые из Института Бродов экспрессировали такую систему в E. coli и показали, что с ее помощью можно специфично доставлять функциональные белки в клетки разных типов.
Credit: Joseph Kreitz, et al. Nature, 2023; DOI: 10.1038/s41586-023-05870-7
Команда Фэна Чжана (Институт Бродов, США) разработала платформу для программируемой доставки белков в человеческие клетки, основанную на сократительной инъекционной системе (contractile injection system, CIS) эндосимбиотической бактерии.
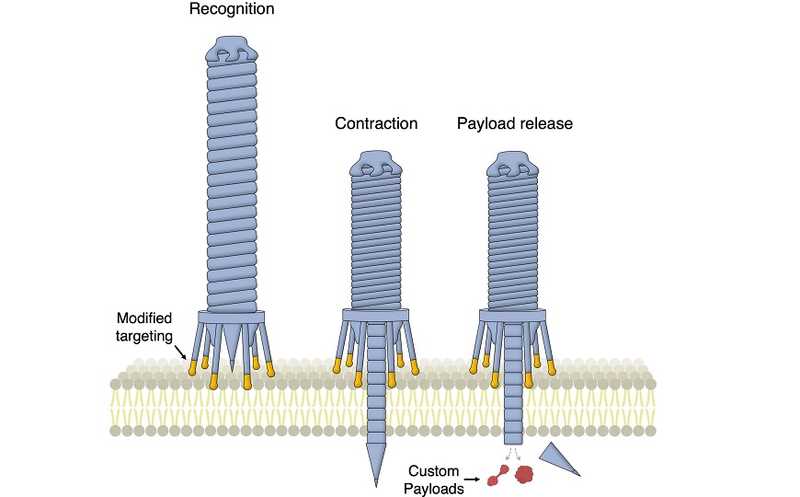
CIS — это макромолекулярный комплекс, напоминающий хвост бактериофага. Он состоит из жесткой трубки, заключенной в сократительную оболочку и прикрепленной к основанию. На конце трубки располагается белок-шип. Бактерии-эндосимбионты используют CIS, чтобы доставить в клетку-хозяина факторы, которые сделают условия их обитания более благоприятными. Полезная нагрузка располагается в просвете внутренней трубки позади шипа. Когда бактерия распознает цель, оболочка CIS сокращается, проталкивает трубку сквозь клеточную мембрану, и груз высвобождается внутри клетки. (Схема приведена на иллюстрации в сопроводительной статье.)
CIS существуют в нескольких формах. Одна из них, eCIS, представляет собой свободный внеклеточный комплекс, который действует независимо от бактерии. Ранее было показано, что eCIS таргетируют клетки мышей. Это навело ученых на мысль об их использовании в качестве инструмента для доставки белка. Авторы нового исследования создали инженерные eCIS, распознающие клетки человека.
Они сосредоточились на одном из подтипов eCIS, PVC, которые продуцируются бактериями рода Photorhabdus — эндосимбионтами энтомопатогенных нематод. Сначала ученые получили штамм кишечной палочки, экспрессирующий PVC. Для удобства они разместили последовательности, отвечающие за разные части комплекса, на разных плазмидах. Затем они выяснили, какие характеристики белка позволяют загружать его в трубку PVC в качестве полезной нагрузки. Оказалось, что на N-конце белка должен присутствовать «упаковочный домен» — высоко неупорядоченная область. Ученые пришили упаковочный домен к белкам, нетипичным для Photorhabdus — GFP, Cre и нуклеазе с цинковыми пальцами. Все три груза связались с PVC, а рекомбинантный PVC успешно доставлял белки в клетки насекомых.
На следующем этапе авторы нацелили PVC на клетки человека. Основываясь на данных о CIS бактериофагов, ученые выяснили, что за тропизм PVS к клетке того или иного типа может отвечать белок хвостового волокна Pvc13 (tail fibre protein). Они предсказали структуру Pvc13 с помощью AlphaFold, а затем навесили на тот конец белка, который предположительно связывается с клеткой, мотив белка аденовируса серотипа 5, специфичного к клетке человека. Инженерный PVC успешно протестировали на человеческих клетках: он доставлял Cas9 в клетки HEK 293FT, экспрессирующие гидовые РНК, и нуклеаза вносила инделы в сайты-мишени. Такой же эффективной была доставка дезаминаз с цинковыми пальцамим в HEK 293FT и эндотоксинов в клетки Jurkat. Ученые показали, что специфичность PVC зависит в основном от взаимодействий хвостовых волокон с рецепторами на поверхности клетки. Модифицируя волокна, можно направлять комплекс на клетки различных типов. Доставка полезной нагрузки осуществляется с высокой избирательностью.
Наконец, авторы протестировали систему доставки на живых мышах. Модификации Pvc13, специфичные к мышиным клеткам, подбирали с помощью AlphaFold. PVC успешно доставил флуоресцентный белок в клетки мозга при внутричерепной инъекции. Инъекция не приводила к воспалительному ответу, активации иммунных клеток или потере веса; цитотоксичности так же не наблюдалось. Сам комплекс PVC оказался короткоживущим: его не было в мозге уже через семь дней.
Таким образом, в работе представлен гибкий инструмент для программируемой доставки белка в клетки-мишени. По мнению авторов, он подходит для целого ряда задач, от биоконтроля до генной терапии.
Гель из бактериофагов можно использовать для деконтаминации продуктов питания
Источник
Joseph Kreitz, et al. Programmable protein delivery with a bacterial contractile injection system. // Nature. Published: 29 March 2023. DOI: 10.1038/s41586-023-05870-7


 Меню
Меню





 Все темы
Все темы




 0
0








