Белок ниндзюрин вскрывает клеточную мембрану в процессе клеточной гибели
Исследователи из Швейцарии, Австрии и Германии установили, что разрыв цитоплазматической мембраны во время программируемой гибели клетки — активный процесс, опосредованный белком ниндзюрином 1 (NINJ1). При полимеризации NINJ1 способен функционировать как застежка-молния, индуцируя повреждения различного размера, через которые высвобождается клеточное содержимое. Более глубокое понимание механизмов клеточной гибели необходимо для поиска новых мишеней терапевтического вмешательства.
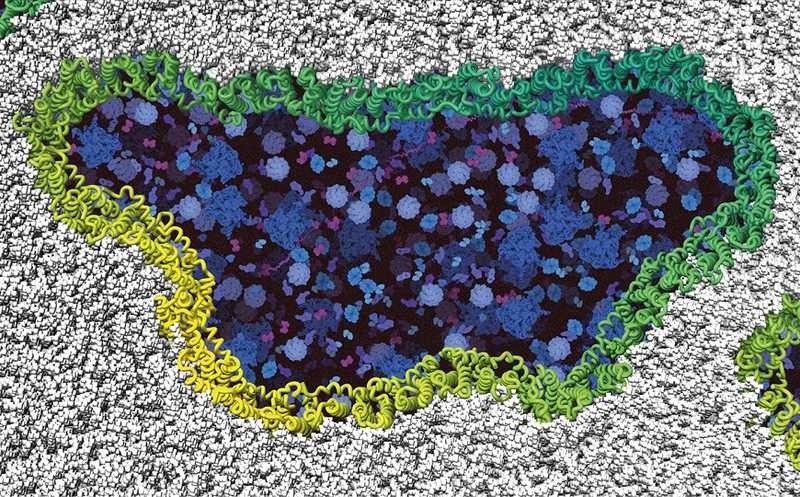
Белки NINJ1 (зеленые и желтые) собираются в филаменты и вскрывают клеточную мембрану (серая). Синим обозначены клеточные компоненты.
Credit:
Biozentrum, University of Basel | Пресс-релиз
Программируемая клеточная гибель завершается разрывом цитоплазматической мембраны. Долгое время считалось, что лизис связан с повышением осмотического давления, которое возникает из-за образования множества мелких пор в мембране и проникновения ионов внутрь клетки. Но исследователи из Швейцарии, Австрии и Германии доказали, что это активный процесс, опосредованный белком ниндзюрином 1 (NINJ1).
При помощи ЯМР и криоэлектронной микроскопии ученые установили структуру NINJ1: он представляет собой высококонсервативный трансмембранный белок, который содержит амфипатические α1- и α2-спиральные участки на внеклеточной поверхности и α3- и α4-спиральные домены, обращенные внутрь клетки. α2 принимает параллельную ориентацию по отношению к α3 и α4, в то время как α1 выступает практически под углом 90° из спирального пучка и соединяется с соседним протомером. За счет нитевидной укладки субъединиц белка образуется структура, которая опосредует лизис клеточной мембраны.
Для установления механизмов функционирования ниндзюрина 1 ученые провели серию экспериментов на различных типах клеток, включая моделирование молекулярной динамики, анализ мутаций и различные виды микроскопии. Авторы обнаружили, что при пироптозе (вид воспалительной программируемой клеточной гибели, индуцированной каспазой 1) амфипатические спирали α1 и α2 встраиваются в мембрану, соединяя соседние протомеры с образованием более крупных полимеров. Полученные высокополимерные молекулы в комплексе с другими белками образуют «точку разрыва» мембраны, стабилизируя повреждения различного размера и морфологии, через которые во внеклеточную среду высвобождается клеточное содержимое. В отличие от других порообразующих белков (GSDMD), мембранные разрывы, вызванные филаментами NINJ1, практически не ограничены в размере. Хотя одиночных филаментов может быть достаточно для повреждения мембран, исследователи предполагают, что NINJ1 образует двойные филаменты, которые открываются наподобие застежки-молнии в ответ на осмотическое давление. «Получив команду самоуничтожения, две молекулы ниндзюрина 1 объединяются и вбивают клин в мембрану», — говорит Моррис Деген, первый автор исследования и аспирант Швейцарского института нанонаук. К образованному остову прикрепляются иные лизирующие белки, которые вызывают окончательное разрушение мембраны и гибель клетки.
Факторы, которые заставляют ниндзюрин 1 полимеризоваться, окончательно не установлены. Ученые предполагают, что фосфатидилсерин, который экспонируется на поверхности мембраны во время гибели клетки, может распознаваться α1- и α2-спиралями NINJ1 и индуцировать полимеризацию белковых комплексов. Определение состава мембраны как потенциального триггера активации ниндзюрина 1 представляется многообещающим направлением исследования.
Полимеризация NINJ1 — важный процесс, способствующий разрыву цитоплазматической мембраны во время клеточной гибели. Понимание атомарной структуры этого механизма открывает возможности для терапевтических вмешательств в контексте различных заболеваний. Это особенно важно для онкологических заболеваний, поскольку опухолевые клетки способны уклоняться от запрограммированной клеточной гибели. Кроме того, в случае неконтролируемого разрушения клеток, наблюдаемого при нейродегенеративных заболеваниях (болезнь Паркинсона, Альцгеймера) или в ситуациях, когда жизни пациента угрожает опасность, например, при септическом шоке, возможным вариантом лечения становится использование лекарств, которые влияют на функции NINJ1.
Клеточные белки ATG7 и ATG14 ограничивают размножение микобактерии в макрофагах
Источники:
Morris Degen, et al. Structural basis of NINJ1-mediated plasma membrane rupture in cell death. // Nature (2023). DOI: 10.1038/s41586-023-05991-z
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0








