Блокирование фермента GCDH запускает апоптоз клеток меланомы
Фермент GCDH участвует в метаболизме лизина и триптофана, важном для роста опухоли. Ингибирование GCDH в клетках меланомы приводит к активации транскрипционного регулятора NRF2, который индуцирует проапоптотический сигнальный путь.
Клетки злокачественных новообразований активно делятся, обеспечивая быстрый рост опухоли. Для этого им необходимо много энергии, которую они получают, метаболизируя различные вещества. Можно ли замедлить или вовсе прекратить рост опухоли, блокируя метаболические пути, которые наиболее активно используются клетками? Поиск ответа на этот вопрос ведется уже несколько лет. В новой работе ученые из США проанализировали важные метаболические пути меланомы и выявили фермент, который в перспективе может стать мишенью для терапии.
Важными источниками энергии для раковых клеток служат лизин и триптофан. Они метаболизируются по общему пути в глутарил-КоА. Из глутарила-КоА под действием глутарил-КоА дегидрогеназы (GCDH) образуется кротонил-КоА. Этот метаболит превращается в ацетил-КоА, который входит в цикл Кребса.
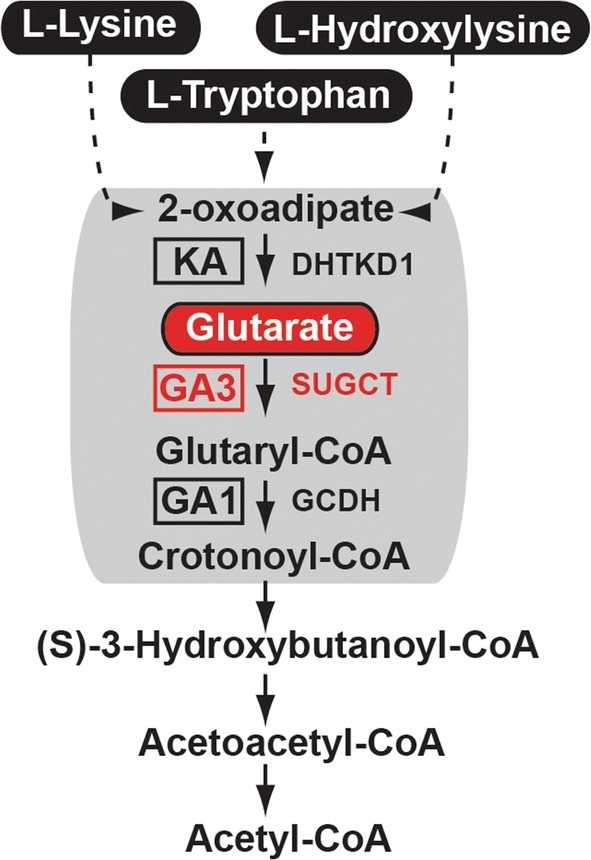 Схема метаболизма лизина и триптофана. Credit: Joanna Niska-Blakie, et al., 2019; DOI:
10.1007/s00018-019-03359-z |
CC BY 4.0
Схема метаболизма лизина и триптофана. Credit: Joanna Niska-Blakie, et al., 2019; DOI:
10.1007/s00018-019-03359-z |
CC BY 4.0
Ранее было показано, что фермент GCDH необходим для выживания организма в определенных метаболических условиях, а его дефицит приводит к активации фактора NRF2 — транскрипционного регулятора ответа на стресс.
На первом этапе ученые in vitro подтвердили зависимость клеток меланомы от GCDH. Используя малые интерферирующие РНК, они инактивировали гены разных ферментов метаболического пути лизина и триптофана. К гибели клеток приводил только нокдаун GCDH. Дальнейший анализ показал, что выключение этого фермента активирует проапоптотическую каспазу 3 и снижает активность антиапоптических факторов.
Чтобы определить механизмы, лежащие в основе гибели клеток меланомы после выключения GCDH, ученые проанализировали уровни экспрессии различных генов с помощью секвенирования РНК. Они показали, что потеря GCDH активирует регуляторные гены ATF3 и ATF4, которые опосредуют увеличение экспрессии DDIT3 и CHAC1. Ранее было показано, что эти гены вовлечены в путь апоптоза, а значит, их активация запускает гибель клеток меланомы.
Одновременное выключение GCDH и фермента DHTKD1, который стоит выше в том же метаболическом пути и катализирует образование глутарила-КоА, «спасало» клетки от апоптоза. Ученые предположили, что главную роль в процессах гибели клеток играет именно глутарил-КоА. Действительно, при ингибировании GCDH уровень глутарата в клетках меланомы повышался и наблюдалось глутарилирование многих белков.
На следующем этапе ученые проверили связь фермента GCDH с функционированием фактора NRF2. Они выяснили, что при нокдауне GCDH увеличивается время полужизни NRF2. Исследования in vitro показали, что NRF2 тоже подвергается глутарилированию. Это увеличивает его стабильность и способность активировать проапоптотические факторы ATF4 и ATF3. Таким образом, гибель клеток меланомы при выключении GCDH опосредована действием NRF2.
Наконец, ученые проверили эффективность ингибирования GCDH in vivo. Иммунодефицитным мышам вводили клетки меланомы, в которых инактивация GCDH индуцировалась доксициклином. Потеря фермента блокировала рост опухоли. Анализ лизатов опухолевых клеток подтвердил отсутствие экспрессии GCDH и повышенную экспрессию NRF2, ATF3, CHAC1 и каспазы 3.
По мнению ученых, фермент GCDH и фактор NRF2 играют ключевую роль в росте и развитии меланомы. Команда активно ищет ингибиторы GCDH, которые смогут стать кандидатными препаратами для терапии меланомы.
Ранее было показано, что развитию меланомы из меланоцитарного невуса препятствует путь Hippo.
Источник
Verma S, et al. NRF2 mediates melanoma addiction to GCDH by modulating apoptotic signalling. // Nature Cell Biology, 2022 Sep 1. DOI: 10.1038/s41556-022-00985-x


 Меню
Меню





 Все темы
Все темы




 0
0








